서론
척추 수술에서 수술중 신경생리 감시(intraoperative neurophysiological monitoring, IONM)는 가장 방법론이 정립되어 있고 효용성이 입증되어 있는 분야 중 하나이다[1]. 1970년대에 척추 수술 중 두피에서 감각유발전위(somatosensory evoked potential, SSEP)를 기록하여 척수신경을 감시하기 시작하였고[2,3], 1980년대에는 운동유발전위(motor evoked potential, MEP)를 추가하여 운동신경계, 피질척수로의 상태를 함께 평가하였다[4,5]. 그 이후로, SSEP와 MEP는 척추수술 중 신경계 감시의 표준적이고 필수적인 방법론으로 활용되어 왔고, 그 밖의 수술의 IONM에서도 가장 기본적인 요소가 되었다.
그러나, 소아의 척추 수술을 위한 IONM은 성인과 수술 적응 질환군이 같지 않고, 신경계의 전기생리학적 특성이 성인과 다르다는 점에서 일반적인 척추 수술의 IONM 방법과 해석을 그대로 적용하기 어렵다. 척추 측만증(scoliosis) 교정수술의 경우, 소아 · 청소년 환자에서 많이 시행되어 왔고, IONM의 발전 과정에서 주요한 임상 적응증의 하나였으므로 일반적인 고려에서 크게 벗어나지 않지만, 그밖에 소아에서 수술이 고려되는 선천성 기형이나 기능적 수술 등은 성인과 달리 특수한 고려를 필요로 한다.
본고에서는 소아에서의 척추 수술을 위한 수술중 신경생리 감시, IONM에 대해 살펴보고자 한다. 문헌 고찰 및 검토와 더불어 그 동안의 저자의 소아 IONM 경험과 관련 연구 결과 등을 함께 다루겠다.
본론
근본적으로 IONM의 임상적 목적은 수술적 치료의 목적을 최대한 달성하면서 신경손상으로 인한 장애의 가능성을 최소화하는 것이다. 예를 들어, 뇌종양 수술에서는 종양을 최대한 제거하면서, 주변의 기능적으로 중요한 신경 구조물을 보존하는 것이 IONM의 목적이고, 척추 측만증 수술에서는 척수 신경이 상하지 않는 범위 내에서 최대한 척추의 정렬을 바르게 하기 위해 IONM을 적용하는 것이다.
소아에서의 IONM의 적용 역시 수술후 기능 결손을 예방하면서 최선의 치료 효과를 거두는 데에 기본적인 목적이 있다. 그러나, 소아에서는 몇 가지 더 고려할 사항들이 있다. 우선은 소아는 신경계를 포함하여 신체와 기능이 성장 · 발달하는 과정에 있기 때문에 수술의 시점과 범위를 정하는 데에 추가적 고려가 필요하다. 예를 들어, 척수결박 증후군(tethered cord syndrome) 환아의 결박분리 수술(untethering) 시점의 결정은 IONM의 발달과 함께 교과서적인 치료 지침이 바뀌었다. 척수 결박 증후군은 환아가 성장하면서 결박이 더 악화되어 신경 기능을 더 약화시킬 가능성이 있으나, 수술 자체의 신경 손상 가능성 때문에, 수술을 일찍 하는 것이 좋은지, 신경학적 결손이 나타날 때 해야 하는지에 대한 고민이 있어 왔다. 이에 대해서는 아래에서 더 자세히 설명하도록 하겠다. 척추 측만증 역시 신경생리와 관련된 고려는 아니지만, 환아의 성장과 변형 정도를 함께 고려하여 수술 시기를 정해야 한다. 신체의 성장 외에도, 소아는 기능이 발달하는 중요한 과정을 거치고 있다. 보행을 포함한 운동 기능도 나이에 따른 발달 지표들이 있고, 연하(삼킴, swallowing)도 적절한 시점에 적절한 자극에 노출되어야 씹고 삼키는 기능을 습득할 수 있다. 따라서, 기능 손실이 우려되는 병변에서는 수술 범위의 결정에 좀더 신중하게 되고, 선택적 후근절제술(selective dorsal rhizotomy, SDR)과 같은 기능적 수술은 환아의 보행 기능 수준에 따라 결정을 하게 된다. 마지막으로, 그러나 마찬가지로 중요하게, 소아는 자기 의사 결정과 표현에 취약할 수밖에 없는 대상이므로 의료진은 항상 적극적으로 소아의 기능과 삶의 질을 최대한 보존하기 위한 최선의 노력을 다하여야 한다. 그리고, IONM의 신중한 시행은 이에 필수적이라 할 수 있다.
척추 측만증 및 편측 척추증(hemivertebrae) 등의 선천성 척추 기형의 교정수술은 앞서 기술했듯이, IONM의 방법론이 매우 잘 발달되어 있다. 척추의 배열(alignment)을 정상에 가깝게 회복시키기 위한 수술에서는 척수 신경이 직접 노출되지 않고 척추체의 정렬에 대한 조작만 이루어지더라도, 척수 신경이 당겨지면서 신경학적 결손이 생길 수 있다. 이러한 손상은 MEP와 SSEP로 매우 “정확”하게 평가할 수 있다. MEP, SSEP의 감소 또는 지연의 기준은 기관에 따라 또는 해석하는 검사자에 따라 달라질 수 있다. SSEP는 반정량적(semi-quantitative) 평가이고, 대개 50% 이상의 진폭 감소 또는 10% 이상의 잠시(latency) 지연을 경고 기준(warning criteria)으로 삼는다. MEP는 정성적(qualitative) 평가에 가까워서, 소실 여부(all or none)만을 기준으로 삼기도 하고, 65%-90%의 감소를 감소의 기준으로 삼기도 한다. Daniel 등이 유소년형 특발성 측만증(adolescent idiopathic scoliosis) 수술 1,121례를 분석한 연구에 따르면, MEP 65% 감소, SSEP 50% 감소를 기준으로 하였을 때, MEP의 민감도(sensitivity)는 100%, 특이도(specificity)는 99.1%였고, SSEP의 민감도는 42.9%, 특이도는 98.4%였다. 음성 예측율(negative predictive value)은 MEP 100%, 99.6%에 이른다[6]. Nuwer 등이 대규모의 다기관 조사를 통해 50,000 건 이상을 분석하여 시행한 연구에 따르면 측만증 수술에서 SSEP만의 민감도, 특이도는 각각 92%, 98.8%였고, 양성 예측율은 42%, 음성 예측율은 99.3%로 확인되었다[7]. 따라서, SSEP, MEP 두 검사를 함께 시행하였을 때, 수술중 척수 손상의 위험을 놓칠 가능성은 거의 없다고 할 수 있고, 달리 말하면 측만증 수술에 IONM을 적절히 시행하지 않아 척수 손상이 발생하는 것은 의료진의 책임을 물을 수 있다고도 볼 수 있다. 즉, 측만증 교정 수술에서 IONM은 임상적으로 필수적인 검사법이라 할 수 있다[7,8].
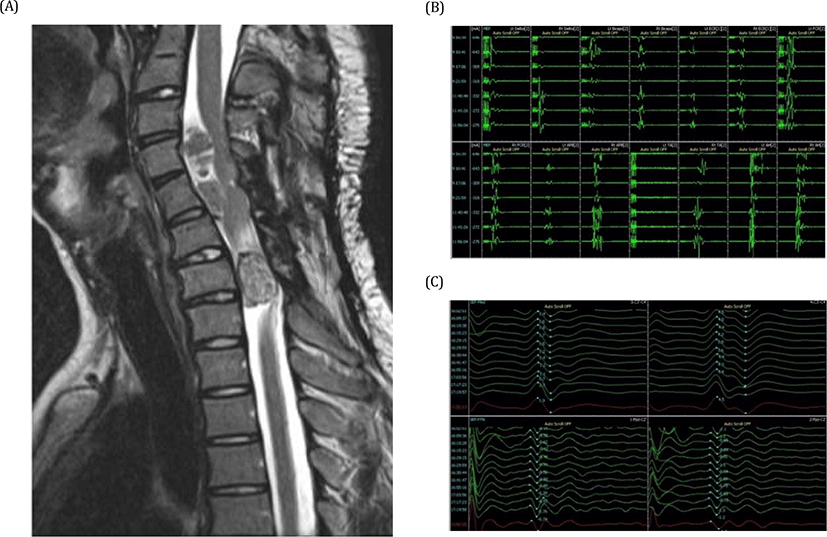
실제 수술 과정에서 MEP와 SSEP를 함께 지속적으로 관찰하여야 하며, 이상이 생긴 경우에는 적극적으로 대처해야 한다. 흉추부 척수는 혈류 공급이 다른 레벨에 비하여 상대적으로 빈약하기 때문에 척수 손상에 더 취약하고, 유발전위가 감소하거나 지연된 경우, 혈압이나 마취 심도 등 전신적인 인자를 교정하는 노력도 필요로 한다. 그리고, 측만증 교정술에서 척수의 당김(cord traction)에 의해 척수 손상이 발생하는 경우 유발전위의 변화가 지연되어서 나타날 수 있기 때문에 교정술의 주요 과정이 끝난 후에도 유발전위를 관찰하는 것이 필요함을 염두에 두어야 한다(Fig.1).
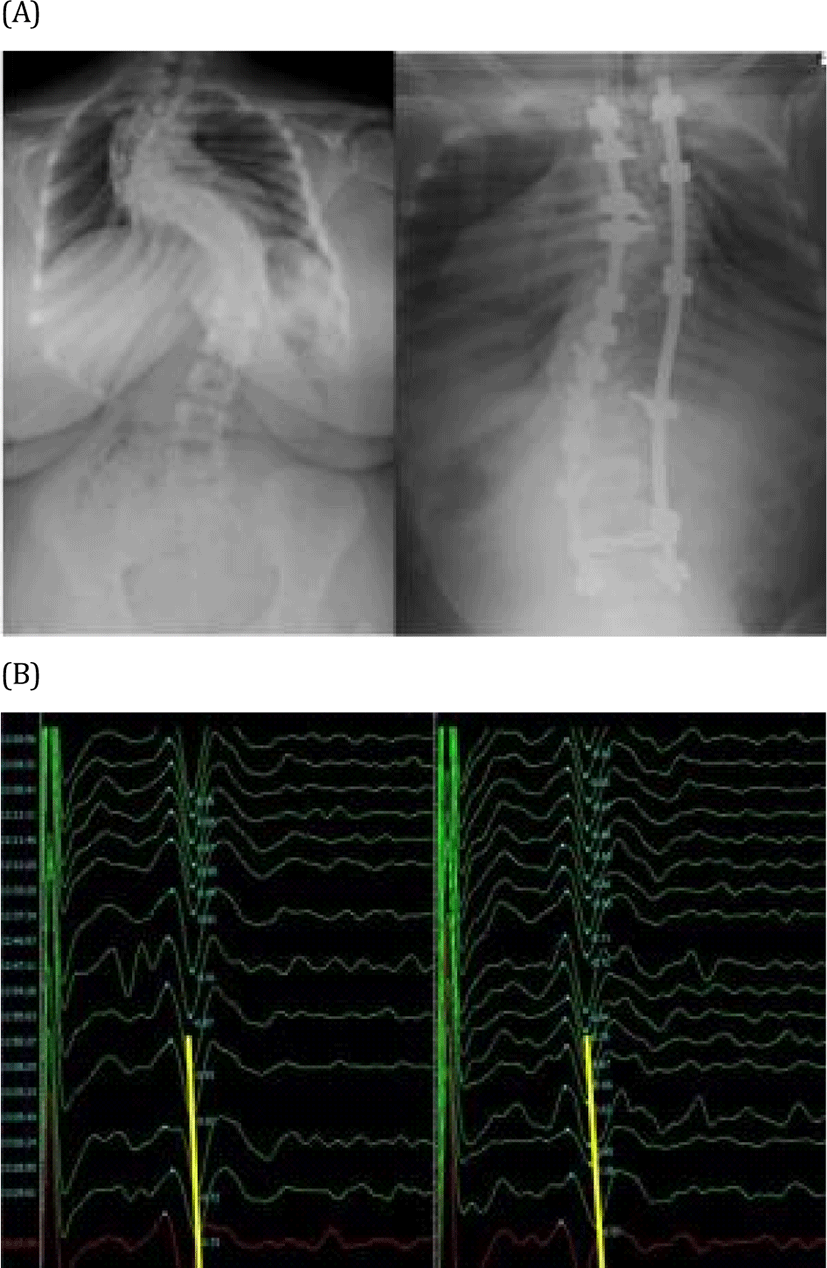
기본적인 SSEP, MEP 검사 외에도 추가적으로 도움이 되는 검사법들이 있다. 기구를 고정하기 위해 척추경(pedicle)에 나사(screw)를 삽입할 때, 신경근(nerve root)의 손상을 예방하기 위해 척추경 나사를 전기 자극할 수 있다[9].척추경 나사 전기 자극(pedicle screw stimulation)은 해당 신경근에 지배되는 근육에 전극을 미리 삽입해 두어 유발 근전도(triggered electromyography) 신호가 나타나는 자극 역치(threshold)를 평가하여 나사와 신경근 사이의 거리가 충분히 떨어져 있음을 확인하는 방법으로, 6 mA의 자극역치를 기준으로 할 때, 90% 이상 예민하게 신경근 손상을 감시할 수 있다[10]. 측만증 교정술의 경우, 흉추부에 기구를 삽입하는 경우가 많으므로, 늑간근(intercostal muscle), 복직근(rectus abdominis) 등의 근육에 미리 기록 전극을 설치해 두어야 한다. 운동신경계 평가에서 MEP 감시가 앞서 설명했듯이 정량적이지 않은 검사라 d-wave 감시를 고려할 수 있다. 더불어, MEP를 유발하기 위해서는 근육의 수축으로 인한 움직임이 동반되어 수술 중에 지속적으로 감시하기 어렵고, 정교한 작업을 중단해야 하는 단점이 있으나, d-wave는 단일 펄스 자극으로 유발되어 전신의 근수축과 움직임이 동반되지 않아, 수술 중에 지속적으로 감시가 가능하다는 장점이 있다.
이분 척추증(spina bifida)를 포함하여 척수 결박 증후군은 성인에 비해 소아에서 더 중요한 수술 적응증이 되는 질환이다. 교과서적으로는 척수 수막류(myelomeningocele)와 같은 이분 척추증이 척수 결박 증후군의 주요 원인 질환으로 기술되나, 이분 척추증은 엽산의 보급 및 산전 진단으로 발병률이 급감하였고, 그 외에 종말끈 비후(thickend filum terminale), 지방척수수막류(lipomyelomeningocele), 선천성 피부동(congenital dermal sinus), 제한적 배측 척수열(limited dorsal myeloschisis) 등 다양한 선천성 기형 질환에서 척추 결박 증후군이 발생하게 된다. 척수 결박 증후군에서 결박분리 수술(untethering surgery)의 결정은 척수 결박에 의한 신경 손상 정도/가능성과 수술로 인한 신경 손상 위험성을 함께 고려하여 결정하게 된다. 예를 들어, 신경학적 결손이 없고, 진행 가능성이 낮은 종말끈 비후의 경우 결박분리 수술이 꼭 필요하지 않다. 그러나, 신경학적 결손이 있고 진행 가능성이 높은 경우라도 수술로 인한 신경 손상의 우려로 인해 결박분리 수술의 결정이 단순하지 않았다. 환아가 성장하면서 척수 결박이 더 악화되어 신경손상이 더 심해질 가능성이 높지만, 병변이 복잡한 경우 수술 자체의 신경 손상이 흔했기 때문이다. 그러나, IONM이 결박분리 수술에 적극적으로 활용되기 시작하면서 수술로 인한 신경 손상이 크게 감소할 수 있었고, 환아의 성장으로 인한 신경학적 결손 진행 전에 일찍 수술을 시행하여 결과적으로 환아의 기능적 예후를 향상시킬 수 있게 되었다[11,12].
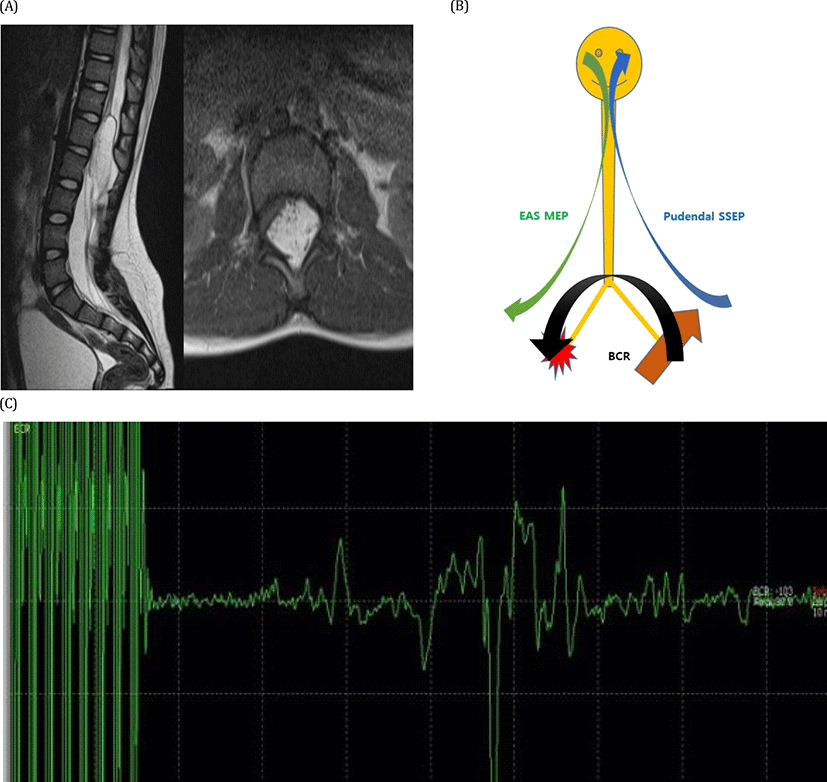
척수 결박 증후군에서 신경 손상은 크게, 척수의 견인으로 인한 효과와 지방종 등 구조적 이상에 의한 직접적인 손상, 두 가지 기전에 의한다. 척수가 당겨지면 혈류가 감소하고, 신경막의 구조가 손상되어 산화 대사 이상 및 전기적 활동 저하가 발생하게 된다. 이러한 견인에 의한 효과는 천수(sacral cord)에서 가장 크게 작용하여, 천수의 신경체(neuron)가 가장 취약하게 손상된다[13]. 따라서, 배뇨 · 배변 기능이 가장 예민한 증상 및 징후가 되고, 결박분리 수술에서도 천수 기능 감시(sacral monitoring)가 가장 중요하다고 할 수 있다. 병변에 의한 직접적인 신경 압박은 해당 요천추 신경근에 지배 받는 양측 하지 근육들을 감시함으로써 이루어진다.
천수 기능 감시는 구해면체반사(bulbocavernosus reflex)의 감시, 외항문 괄약근(external anal sphincter)의 MEP 감시, 그리고 음부 신경(pudendal nerve) SSEP의 감시를 활용할 수 있다[14].외항문 괄약근 MEP는 운동신경로를, 음부 신경 SSEP는 감각신경로를 평가할 수 있는 데 반하여, 구해면체반사는 천수 이하의 운동과 감각 신경 경로를 동시에 평가할 수 있는 장점이 있다. 필자와 동료들의 연구를 통해 구해면체반사는 결박분리 수술 후 배뇨 기능의 예측에 매우 유용함이 밝혀져 있다(Fig. 2)[15].
요천추 신경근의 확인(mapping) 및 감시는 다양한 레벨의 요천추 신경근에 의해 지배되는 하지 근육들의 유발(triggered) 또는 자발(free-running) 근전도(electromyography, EMG)를 관찰함으로써 이루어진다. 지방종 등을 제거할 때 해당 부위에 신경 조직이 없음을 확인하기 위해서는 전기 자극기를 적용하여 유발 근전도가 하지 근육 및 외항문 괄약근에서 유도되지 않음을 확인하여야 한다. 동심 양극 자극기(concentric bipolar stimulator)가 더 선택적으로 자극을 가할 수 있고, 일정 전류 강도 이하에서 유발 근전도가 나타나지 않으면, 자극 부위 바로 인근에는 신경 조직이 없다고 볼 수 있다. 역치는 병변, 수술 과정 및 외과의의 술기에 따라 달리 고려가 필요하나, 대체로 1-5 mA에서 역치를 정하여 수술을 진행할 수 있다.
종말끈(filum terminale)의 확인 및 절제를 위해 종말끈의 자극 역치가 운동 신경근과 비교해 100배 차이가 난다는 경험적 관찰을 활용할 수 있다[16].즉, 운동 신경근의 자극 역치가 0.5 mA라면 종말끈은 50 mA까지 자극하여도 전류 퍼짐(current spread)에 의한 유발 근전도가 관찰되지 않는다는 것이다. 꼭 100배까지 자극하여 확인할 필요는 없고, 10-15 mA에서 유발 근전도가 나오지 않으면 대체로 신경 조직은 포함되지 않았다고 볼 수 있다.
자발 근전도는 결박분리 수술 과정에서 신경근이 건드려지거나, 당겨질 때마다 관찰될 수 있다. 매우 예민한 지표이기 때문에, 자발 근전도가 관찰될 때마다 수술을 중단하거나, 신경 손상을 의심할 필요는 없다. 자발 근전도가 관찰되면 근처에 신경근이 포함되어 있다는 신호로 받아들이고, 자발 근전도가 신경긴장성 방출(neurotonic discharge) 형태로 지속되면 MEP를 확인하여 신경 손상 여부를 확인하는 것이 필요하다.
선택적 후근 절제술, SDR은 주로 경직성 뇌성마비 환아에서, 경직을 감소시켜 보행 및 운동 기능을 향상시키거나, 자세 유지나 위생 관리에 도움을 받기 위해 시행한다. 전자의 적응증은 더 기능적인 뇌성마비 환아에서의 고려 사항이고, 후자의 경우는 독립적 기능이 제한된 중증의 뇌성마비 환아에서의 고려에 해당한다고 볼 수 있다.
SDR에서 IONM의 역할은 어느 신경세근(rootlet)을 절제하고, 어느 신경세근을 보존할 지의 근거를 제공한다. 이론적으로 뇌성마비에서의 경직은 과항진된 감각-운동 신경 반사 회로에 기인한다고 가정하고[17,18], 감각 신경세근을 자극하여 운동 근육에서 과항진된 반응이 더 심하게 관찰되면 해당 신경세근을 선택하여 절제하는 것이 SDR의 원리이다[19,20].그러나, IONM 소견에 따른 신경세근 절제가 임상적으로 더 효과적인지에 대해서는 근거가 아직 모호하다. 감각 신경세근 자극에 의한 과항진된 반응이 믿을만한 지표인지[21], 과항진 반응이 경직에 특이한 현상인지[22-24], 선택적 절제와 비선택적 절제의 임상적 효과에 차이가 있는지[25] 등은 논란이 있어 왔다. 그럼에도 불구하고, 이론적 배경을 바탕으로 임상적으로 널리 시행되어 효능이 확인되어 있는 술기에 대해, 이에 적극적으로 반박하는 증거가 나오기 전까지는 기존의 방법론을 따르지 않을 이유가 없다[26].
과항진된 반사 회로를 판별하는 기준으로는 크게, 자극 후에도 지속되는 활동(sustained activity, Peacock’s criteria) 을 근거로 한 기준[27]과, 자극된 신경근 레벨 너머 근분절(myotome)로 퍼져 나가는 양상(myotomal spread, Phillip and Park’s grading scheme)을 근거로 한 기준이 있다[28]. 어느 기준을 따를지는 외과의의 선호 및 병원의 환경에 따라 두 기준을 적절히 조합하여 사용할 수 있다(Fig. 3)[29].
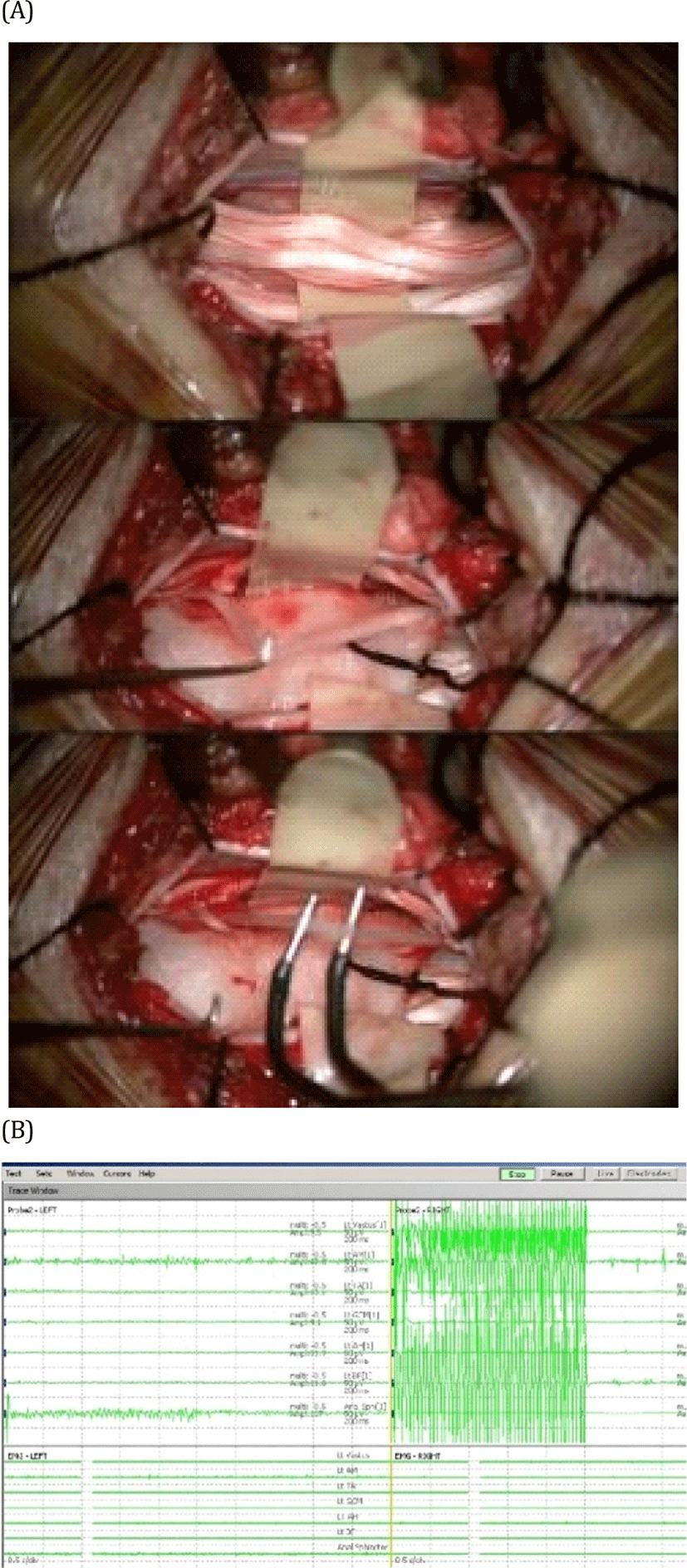
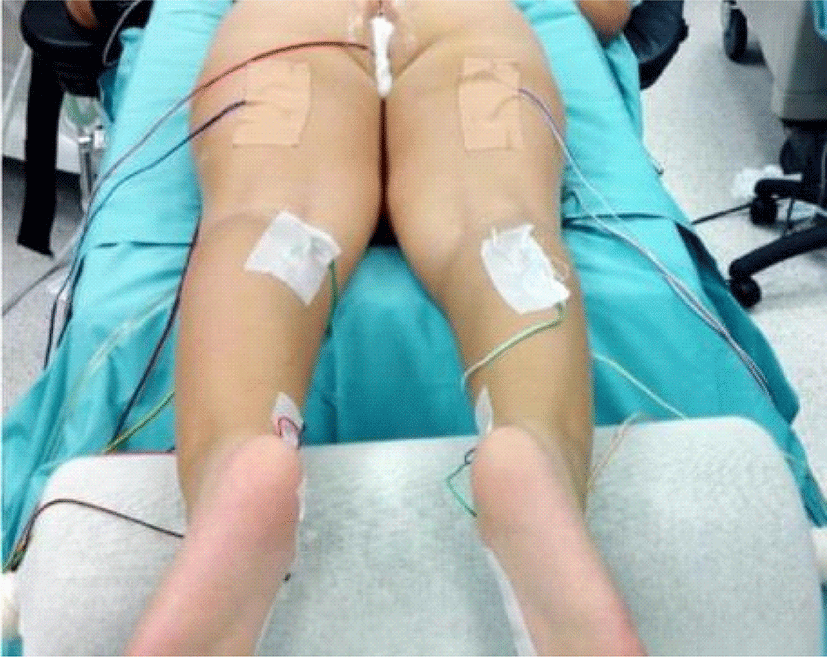
실제 과정은 다음과 같다. 주로 양하지 경직성 뇌성마비(diplegic spastic cerebral palsy) 환아가 대상이 되기 때문에, 양 하지의 각 근분절 별로 기록 전극을 설치하게 된다. 특히, 경직에 주로 기여하는 대내전근(adductor magnus)과 내측 뒤넙다리근(medial hamstrings)을 포함하는 것이 권장된다. 천수 기능의 보존을 확인하기 위해 외항문괄약근을 감시하는 것도 필요하다. 필자의 수술장에서는 머리쪽 근분절부터 차례로 대내전근, 대퇴사두근(quadriceps femoris), 전경골근(tibialis anterior), 비복근(gastrocnemius), 단무지외전근 (abductor hallucis), 내측 뒤넙다리근, 외항문 괄약근에 전극을 설치하여 준비한다(Fig. 4). 수술 중 마미(cauda equina)를 노출시킨 뒤, 후근(dorsal roots)과 전근(ventral roots)을 분리하고, 요추 1번부터 천추 2번까지의 각 신경근을 확인한다. 각 신경근에 대해 전기 자극을 가하여 반응을 통해 신경근 레벨을 확인하고, 운동 신경근이 포함되어 있지 않은지 재검한다. 그 뒤, 각 신경근을 3-7가닥의 신경세근으로 분리하고, 신경세근 별로 역치 자극(threshold stimulation)을 하여 역치를 확인한다. 각 신경세근에 대해 확인된 자극 역치로 1초간 50-60 Hz의 연축 자극(tetanic stimulation)을 가하여 감각-운동 반사 반응을 기록하고, 과항진된 비정상 반응인지 여부 및 정도를 평가하고 기록한다. 과항진 반응 정도에 따라 각 신경근에서 일정 분율의 신경세근을 절제하는 것이 수술의 과정이다.
경직을 효과적으로 줄이기 위해서는 무릎 굽힘근을 포함하는 S2 레벨까지 신경세근을 선택 절제하는 것이 권장되는데, S2 신경근에서는 배뇨/배변/성기능 등 천수 기능을 일부 담당하기 때문에, 천수 기능 저하의 가능성을 줄이기 위해 외항문 괄약근 반응을 확인하거나, 회음부 감각 자극 후 신경근에서 감각활동전위 유발 여부를 평가할 수 있다[30].
척수 종양의 수술 및 IONM은 성인과 기본적으로 다르지 않다. 척수 종양은 종양의 병리소견, 레벨, 위치에 따라 수술의 방침 및 IONM을 달리 하게 된다. 척수 종양은 척수와의 상대적 위치에 따라 척수내(intramedullary) 종양과 척수외(extramedullary) 종양으로 나눌 수 있고, 척수내 종양의 수술이 특히 신경 손상의 우려가 높기 때문에 IONM의 적극적인 활용이 필요하다.
척수 종양의 IONM에서도 MEP, SSEP의 감시가 척수를 지나는 운동신경로 및 감각신경로의 평가의 기본이다. 앞서 설명했듯이, MEP 감소 및 SSEP 감소/지연의 기준은 주어진 검사 환경과 검사자에 따라, 증례별로 달라질 수 있지만, 대체로 MEP는 반응의 유 · 무(all or none)를 주 기준(major criteria) 으로 삼고, SSEP는 50% 감소 또는 10% 지연을 기준으로 삼는다. MEP를 all or none의 주 기준보다 좀더 예민하게 평가하기 위해서는 부 기준(minor criteria)을 함께 고려할 수 있다. 부 기준으로는 자극 역치의 증가[31], 위상 수(phasicity)의 감소[32], 위상 수 증가[33] 등을 고려해 볼 수 있다.위상 수의 증가가 운동 기능 결손을 예측할 수 있음에 대한 연구는 척수내 종양 환자만을 대상으로 하였고, 위상 수 감소가 유용함을 보고한 연구는 다양한 환자군(척수 종양, 측만증, 경추 척수증 등)을 대상으로 하여 결과가 상반되게 나타났을 것으로 해석된다. 그러나, 여전히 MEP는 정성적이지 않은 평가라 주관적 해석의 여지가 많이 남아, 척수 종양 수술에서는 더욱 d-wave 감시가 권장된다. 척수내 종양 수술에서 d-wave 감시를 통해 더욱 정확하게 기능적 예후를 예측할 수 있음이 알려져 있다.예를 들어, MEP가 소실되더라도 d-wave 진폭이 50% 미만으로 감소한 경우 일시적 운동 결손 후 회복되나, d-wave 진폭이 50% 감소한 경우, 운동 기능 저하가 지속됨이 알려져 있다(Fig. 5)[34,35].
척수 종양이 해당 레벨의 하부 운동신경원(lower motor neuron)이나 신경근을 직접 이환하는 경우, 신경근에 대한 확인 및 감시가 함께 필요하다. 하부 운동신경원과 신경근의 평가는 해당 근분절의 근육에서 자발 근전도를 관찰하고, 근 MEP를 측정하여 평가할 수 있다. 수술 부위의 근분절에 해당하는 근육에서 신경긴장성 방출 형태의 자발 근전도가 관찰되거나 MEP가 감소되면, 신경근 또는 하부운동신경원의 손상을 의심할 수 있다[36,37]. SSEP의 평가도 참고가 되나, SSEP를 통해 평가 가능한 신경근 레벨은 매우 제한적이다.
척수내 종양의 수술에서 척수절개(myelotomy) 시에, 정확한 정중 솔기(dorsal median raphe)의 위치를 확인하기 위한 후기둥 매핑(dorsal column mapping)도 유용할 수 있다. 후기둥 매핑은 두 가지 효용이 있다.정확하게 정중 솔기로 절개하지 않으면 수술 중 후기둥이 손상되어 SSEP 감시가 불가능해지는 데 이를 피할 수 있다는 것과, 결과적으로 후기둥의 손상을 예방하여 수술 후 고유수용 감각의 저하를 방지할 수 있다는 것이다. 후기둥 매핑에는 세가지 다른 방법이 고려될 수 있다. 척수를 자극하여 말초신경에서 역방향 감각 활동전위(antidromic sensory nerve action potential)를 기록하는 것, 말초 신경을 자극하여 척수에 수평방향으로 촘촘하게 설치한 전극에서 정방향 감각유발전위(orthodromic sensory nerve action potential)를 확인하는 방법[38], 그리고 척수에서 수평방향으로 각기 다른 위치에서 자극을 가하여 두피에서 기록되는 SSEP의 위상이 전환되는 지점을 찾는 방법 등이다[39].
아놀드 키아리 기형은 크게 1형과 2형으로 나눌 수 있다. 1형은 두개저의 대공(foramen magnum)에 소뇌의 일부가 내려와 있는 경우를 가리키고, 2형은 척추 이분증과 동반된 경우를 가르킨다. 척추 이분증에 대한 고려는 위의 설명을 참고하면 된다. 두개저 부위에 국한된 수술, 후두부 감압술(foramen magnum decompression)의 경우, 신경학적 결손의 위험성은 상대적으로 낮기 때문에, IONM관련 문헌이나 연구에서 널리 다루어지는 주제는 아니다. 그러나, 고위 경수 및 뇌간을 포함하는 수술이라 신경 손상이 발생하는 경우 심각한 후유증이 있을 수 있고, 두개 감압술 및 경막성형술의 범위 및 효과를 평가하기 위해서 SSEP 및 뇌간 청각 유발전위(brainstem auditory evoked potential, BAEP) 등의 전기생리학적 평가를 고려할 수 있다[40,41].
토의 및 제언
본고에서는 소아에서 IONM의 적응이 되는 주요 척추 · 척수 · 신경근의 수술에 대하여 살펴보았다. 근본적으로 성인 척추 수술의 IONM과 다른 방법론이 적용되지는 않지만, IONM의 시행 및 신호의 해석에 있어 소아의 특수성을 반드시 고려하여야 한다. 우선 소아의 신경계는 충분히 성숙하지 못한 상태로 수초화(myelination) 및 시냅스 형성(synaptogenesis)이 진행 중이라는 것이다[42]. 특히 3세 이하의 소아에서는 연령에 따른 신경계 기능의 차이가 크다. 가령, MEP 또는 BCR(bulbocavernosus reflex) 등 시냅스를 거치는 반응을 유발하고자 하는 경우, 성인과 같은 자극 프로토콜을 적용하였을 때 반응이 안정적으로 나오지 않는 경우들이 흔하여, 자극 펄수의 개수 및 펄스 간격 등을 달리 해가며 최적의 프로토콜을 찾는 노력이 필요하다[14]. 신체 크기 및 해부학적 차이도 고려되어야 한다. 자극 전극과 기록 전극의 거리가 상대적으로 가까워 자극 아티팩드(stimulation artifact) 및 부피 전도(volume conduction)의 가능성이 높고, 두꺼운 피하지방으로 전극의 임피던스에 영향을 미친다. 18개월 이전에 천문(fontanel)이 닫히지 않아서 두피 전극 설치시 주의가 필요하다. 다음으로, 마취에 의한 생리적 반응도 성인과 다르다. 소아는 할로탄 흡입 마취에 의해 유발전위가 성인보다 현저히 저하된다[43].
따라서, 소아의 IONM을 효과적으로 수행하기 위해서는 소아의 신경생리에 대해 충분히 이해하여야 하고, 마취전문의와 적극적으로 의사소통 · 협력하여야 하며, 소아에게 적합한 프로토콜과 이상 기준을 찾기 위해 연구와 노력이 필요하다.
중요하게는 IONM을 활용하여 소아의 척추 수술에서 신경학적 예후를 향상시킬 수 있음을 보이는 근거를 확보하고, IONM을 통해 소아에서 신경생리학적, 신경병리학적 이해를 더욱 깊이 하려는 노력이 필요하다. 소아에서의 IONM은 여전히 표준적인 방법론이 성인에 비해 정립되어 있지 않고, 근거 수준이 높지 않아 검사자의 직관과 경험에 많이 의존하고 있다. 척수 결박 증후군이나, 뇌성마비 환아의 선택적 후근절제술 등의 신경생리학적 평가는 이론적 근거가 완전하지 않아 기초 연구도 함께 필요하다.
결론
소아 척추 수술은 성인과는 수술 적응 진단이 매우 다르다. 그러나, 마찬가지로 신경 손상과 이로 인한 기능 장해의 가능성이 있고, 특히 발달 과정에 있는 소아에서는 이에 대한 고려가 더욱 중요하다. 이러한 면에서, IONM은 소아 척추 수술에 유용하고 안전하며 권장되는 기술이라고 할 수 있다. 척추 측만증의 교정수술에서 IONM의 시행은 장애의 가능성을 줄이기 위한 표준적이고 필수적인 검사법이라 할 수 있다. 척추 결박 증후군의 결박분리 수술은 IONM의 발전과 적용으로 수술의 시행에 대한 표준 지침이 달라졌다고 볼 수 있다. 선택적 후근절제술은 IONM의 평가에 따라 절제하는 신경세근을 결정하므로, IONM에 대한 충분한 이해 및 경험이 매우 중요하다. 그 밖에 종양, 발달 기형 등의 수술에서 IONM의 활용은 환아의 수술 성적을 향상시키면서 장애를 최소화하기 위해 도움이 될 수 있다. 그러나, IONM 자체가 여전히 발전의 여지가 많은 학문이고, 특히 소아에서의 경험은 상대적으로 적어서 더욱 연구하고 발전시켜 나아가야 할 것이다.
