서론
경동맥내막절제술(carotid endarterectomy, CEA)은 증상 또는 무증상 내경동맥협착(symptomatic or asymptomatic internal carotid artery stenosis) 환자에서 2차적인 뇌경색 발생을 감소시킬 수 있는 효과적인 치료이다[1]. 하지만 수술 합병증(complication), 이환율(morbidity) 및 사망률(mortality)을 모두 고려할 때, 수술로 얻는 이익은 재고할 필요가 있다. CEA 수술 중 허혈뇌혈관질환(ischemic cerebrovascular disease)은 약 2%–3%에서 발생하는데[2], 대부분 혈전 색전(thromboembolus)이나 뇌관류저하(cerebral hypoperfusion)에 의해 일어나며, 뇌관류저하의 경우 많게는 CEA 수술 환자의 약 15%에서 이를 경험하게 된다.
뇌관류저하가 바로 뇌경색을 일으키지는 않기 때문에 수술중신경계감시(intra-operative neurophysiological monitoring, INM)를 통해 이를 조기에 발견하여 경동맥 션트(shunt)나 혈압상승 등의 방법으로 뇌관류를 회복시킨다면 허혈뇌혈관질환 발생을 감소시킬 수 있다. 이러한 수술 중 신경계 감시 장치에는 체성감각유발전위(somatosensory evoked potential, SSEP), 운동유발전위(motor evoked potential, MEP), 뇌파(electroencephalography, EEG), 두개경유도플러(transcranial Doppler, TCD), 경동맥 기부압력(stump pressure, SP) 측정 등이 있다[3].
본 논문에서 저자들은 내경동맥 협착 환자에서 CEA 수술시 SSEP, MEP, EEG를 이용한 INM을 시행하여 적절한 대상자에서 늦지 않게 경동맥 션트를 시행, 수술 합병증을 예방하였던 증례를 보고하고자 한다.
증례 1
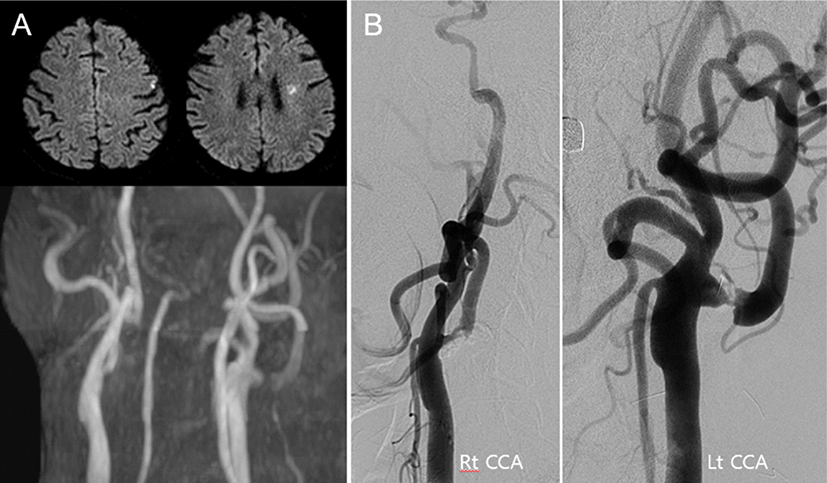
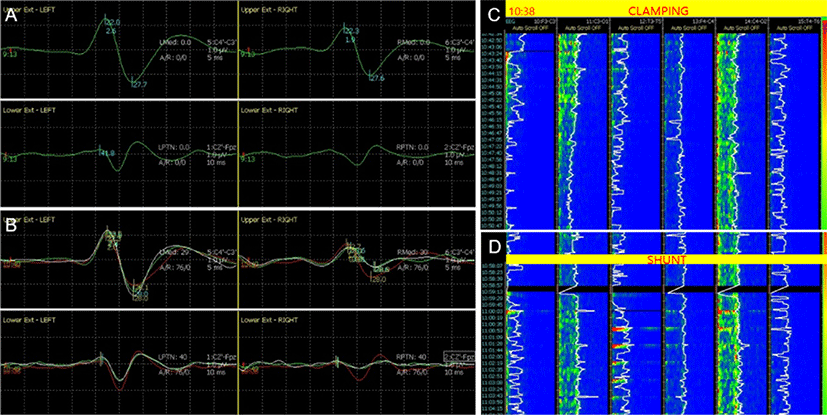
고혈압, 당뇨병, 고지질혈증 및 협심증으로 10년 전 경피적 관상동맥중재술(percutaneous coronary intervention) 시행 후 투약 중이던 64세 남자가 조음장애로 병원에 왔다. 뇌 MRI에서 좌측 대뇌부챗살 및 전두엽 피질의 뇌경색이 확인되었으며, 경동맥 자기공명혈관조영(magnetic resonance angiography, MRA)에서 심한 양측 내경동맥 협착이 관찰되었다(Fig. 1-A). 6개월 뒤 시행한 대퇴동맥경유뇌혈관조영술(transfemoral cerebral angiography, TFCA)에서 좌측 내경동맥은 NASCET(North American Symptomatic Carotid Endarterectomy Trial) 계산법으로 90%의 협착을 보였으며(Fig. 1-B), 이에 대하여 CEA를 한 다음 관상동맥우회로조성술(coronary artery bypass surgery, CABG)을 계획하였다. 마취는 프로포폴(propofol)과 레미펜타닐(remifentanil)을 사용하여 완전정맥마취(total intravenous anesthesia, TIVA)를 시행하였고, INM을 위해 양측 상하지의 SSEP, MEP와 정량적 뇌파(quantitative EEG, qEEG)를 기록하였다. SSEP는 정중신경과 뒤정강신경에서 상지는 30 mA, 하지는 40 mA의 세기, 0.3 ms의 지속시간, 2.31 Hz의 빈도로 자극하고, C3’-C4’, C4’-C3’, CZ’-Fpz에서 기록하였다. MEP는 두개경유전기자극(transcranial electrical stimulation) 방식으로 C3-C4 위치에서 350 V의 세기로 5회 펄스 반복자극하고, 양측 엄지두덩근육(thenar muscle), 앞정강근(anterior tibialis muscle), 엄지벌림근(abductor hallucis muscle)에서 기록하였으며, 마취 유도(induction) 후 SSEP(Fig. 2-A)와 MEP의 기준값(baseline)을 얻었다. qEEG는 6채널 몽타주(F4’-C4’, C4’-O2’, T4’-T6’, F3’-C3’, C3’-O1’, T3’-T5’)에서 기록하였으며, 밴드파워(band power)와 spectral edge frequency(SEF)를 모니터링 하였다. 경동맥 클램프(clamp)를 시행하고 약 5분 후, 우측 상지의 SSEP 진폭(amplitude)이 약 58% 감소하였고, 우측 하지 SSEP가 관찰되지 않았다(Fig. 2-B). 동시에 좌측 대뇌반구 전반에 걸쳐 EEG의 빠른 활동(fast activity)이 감소하고, 느린 활동(slow activity)의 증가가 qEEG 밴드파워에서 나타났으며, SEF가 점차 감소하였다(Fig. 2-C). 뇌관류저하 발생을 시사하는 소견으로 판단하고 곧바로 경동맥 션트를 권고하였으며, 션트 시행 후 SSEP의 진폭은 상지와 하지에서 각각 baseline의 74%와 68%까지 회복되었고, qEEG의 밴드파워 및 SEF 또한 점차 회복되었다(Fig. 2-D). 클램프 제거 후 뇌관류는 정상적으로 유지되었으며, 수술 중 MEP 파형의 변화는 관찰되지 않았다. 수술 후 환자는 추가적인 신경학적 이상은 관찰되지 않았다.
증례 2
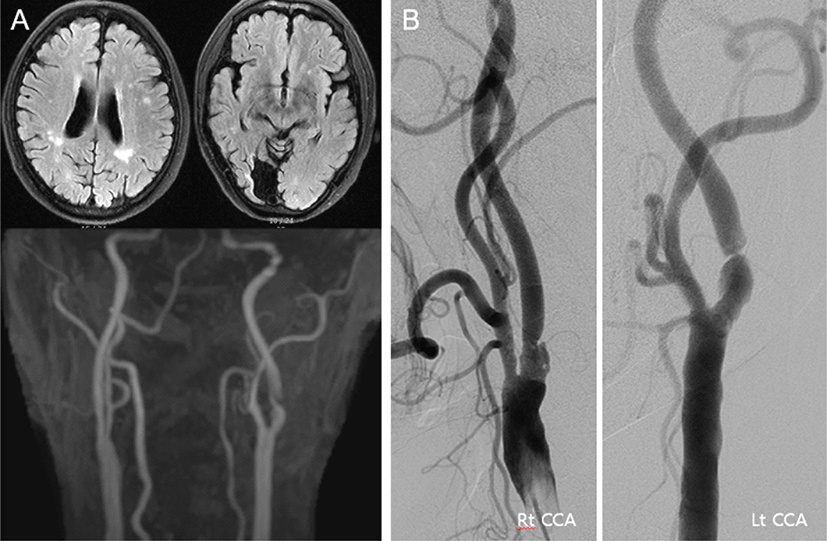
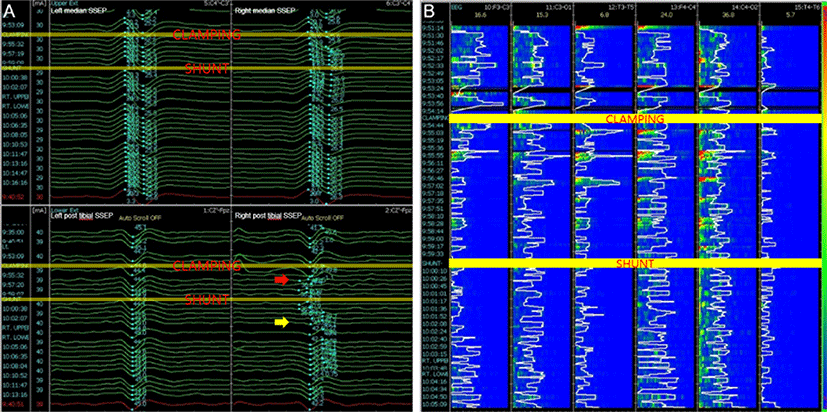
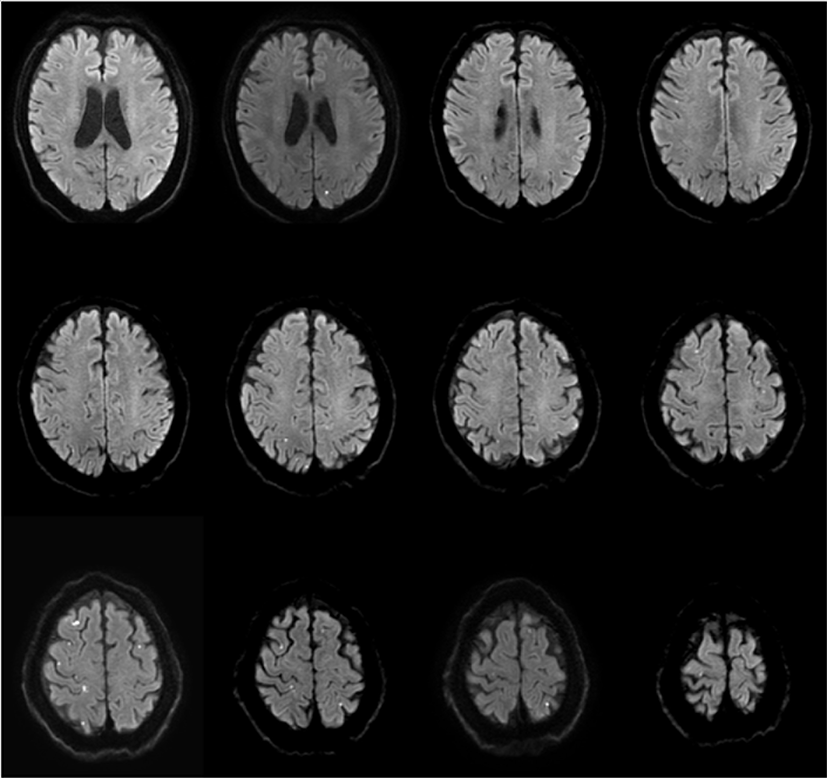
우측 후대뇌동맥영역의 뇌경색이 30년 전에 있었고, 고혈압, 당뇨병, 고지질혈증, 우울증으로 투약 중이던 68세 남자가 증상은 없으나, 경동맥 초음파에서 우연히 관찰된 양측 내경동맥 협착으로 병원에 왔다. 뇌 MRI에서 좌측 전두엽 피질하 백질에 국소적인 T2강조 고신호강도(high signal intensity) 병변이 보였고(Fig. 3-A), TFCA에서 NASCET 계산법으로 85% 협착이 좌측 내경동맥에서 관찰되어(Fig. 3-B) CEA를 계획하였다. 마취는 TIVA로, INM은 SSEP, MEP, qEEG를 위에서 기술한 바와 같이 진행하였다. 경동맥 클램프를 시행하고, 약 3분 뒤 우측 하지의 SSEP가 갑자기 소실되었고, 우측 상지의 SSEP 진폭은 66% 감소하였다(Fig. 4-A). 같은 시간에 qEEG에서는 좌측 반구, 특히 F3’-C3’에서 SEF가 급격히 감소하고, 밴드파워가 감소하였다(Fig. 4-B). 집도의에게 이를 알려 션트를 권고하였고, 5분 안에 션트를 시행하였다. qEEG의 밴드파워와 SEF는 션트 시행 후 3분만에 회복되었고(Fig. 4-B), SSEP도 상하지 모두에서 정상파형을 회복하였다(Fig. 4-A). 클램프를 제거한 후 qEEG, SSEP 모두 정상수준을 유지하였으며, 수술 중 MEP 파형의 변화는 관찰되지 않았다. 수술 직후 환자는 신경학적 이상은 없었으나, 수술 후 5일째 경미한 어지럼증을 호소하였다. 뇌 MRI 확산강조영상(diffusion weighted image)을 시행하였고, 양측 전두엽과 두정엽의 피질 및 피질하 백질에 미세한 다발성 확산제한 병변만 관찰되었다(Fig. 5). 환자의 어지럼증은 수일 이내에 대증 치료로 호전되었고, 별다른 증상 없이 퇴원하였다.
고찰
위의 두 증례는 각각 증상 및 무증상 경동맥협착 환자에서 CEA 시행 중 뇌관류저하가 발생하였으나, 적절한 경동맥 션트로 뇌경색 발생을 피할 수 있었던 환자들을 보고하였다. CEA 중 INM을 통해 뇌관류저하의 발생을 확인하면, 혈압을 증가시키거나, 경동맥 션트를 시행하여 뇌관류를 정상 범위로 회복시켜 뇌경색 발생을 막을 수 있다. INM을 통한 뇌관류 모니터링 없이 모든 환자에서 혈압상승 또는 션트를 시행을 고려할 수도 있으나, 혈압을 높이면 심근경색의 위험성을 증가시킬 수 있고, 션트를 시행하면 수술시간의 연장, 혈전색전증 발생 및 경동맥박리 위험성 증가를 초래할 수 있다. INM을 통한 선택적 션트(selective shunt)와 모든 환자에 대해 관례 션트(routine shunt) 시행을 비교한 기존 연구에서도 선택적 션트 그룹에서 뇌졸중 발생률이 관례 션트 그룹보다 유의하게 낮음을 보였다[4].
뇌파를 이용한 INM은 CEA에서 뇌졸중 발생률을 1% 미만으로 낮출 수 있었다[5]. 뇌관류저하가 나타나면 뇌파에서 알파, 베타 영역의 fast activity가 감소하고, 세타, 델타 영역의 slow activity가 증가하게 되어, 뇌파 모니터링에서는 fast activity가 50% 이상 감소할 때나 slow activity가 50% 이상 증가할 때를 알람 기준으로 정하고 있다[6]. qEEG에서는 SEF가 1분 이내에 빠르게 50% 이하로 감소하여 10분 이상 지속될 때나 밴드파워가 50% 넘게 감소하였을 때를 알람 기준으로 정하고 있다[6].
CEA에서 SSEP를 이용한 INM은 알람 기준을 잠복기(latency)의 10% 이상 증가 또는 진폭의 50% 이상 감소로 정하고 있으며[7], EEG에 비하여 뇌졸중 감시에 대한 민감도와 특이도가 낮지 않음이 메타분석을 통해 입증되었다[8,9]. SSEP 모니터링 시에는 상지만 시행하는 것보다 상지와 하지를 동시에 시행하거나, MEP까지 같이 시행할 경우, 그 민감도를 더욱 향상시킬 수 있으며, EEG와 SSEP를 모두 이용할 경우, 둘 중 한 가지를 이용하는 경우보다 수술 중 이상을 감시할 수 있는 민감도를 높일 수 있음도 보고되었다[8]. 본 증례 1의 환자에서도 상지 SSEP 진폭 감소는 알람 기준을 조금 넘어선 정도(58%)였지만, 하지 SSEP는 관찰되지 않는 더 명확한 파형 변화를 보여주었고, 같은 시간대의 뇌파 변화 또한 두드러져 경동맥 션트 시행에 결정적인 역할을 하였다. 증례 1과 2에서 qEEG는 연속적인 파형 변화의 흐름을 보여주지만, 밴드 파워가 비교적 서서히 감소하고, 50% 이상 감소한 시점을 특정 짓기에는 다소 어려움이 있었다. 이때, SSEP를 같이 관찰하여 알람 기준을 명확하게 만족함으로써 경동맥 션트 여부를 결정하는 데에 중요한 역할을 하였다. SSEP의 경우, 평균화(averaging)가 필요하기 때문에 초 단위의 연속적인 측정이 불가능하고, 따라서 EEG와 SSEP를 같이 사용할 때 더 빠르고 명확한 알람 기준 감지가 가능할 수 있다. 다만 EEG와 SSEP 중 어느 검사가 우월한지에 대해서는 더 많은 연구가 필요하다.
수술 전에 클램프 후 뇌관류 저하를 예측할 수 있는 인자로는 반대측 경동맥 막힘, 당뇨병, 증상성 경동맥질환이 있으며, 남자보다 여자에서 더 많이 발생하는 경향이 있다[10]. 뿐만 아니라 반대측 경동맥협착이 심할수록 클램프 후 INM 변화가 발생하거나 션트를 시행해야 하는 경우가 증가하였다[10]. 본 논문의 두 증례는 모두 당뇨병이 있고, 반대측 경동맥의 협착이 있어 뇌관류 저하로 인한 INM 변화 가능성이 높은 환자들이었다.
결론적으로, 저자들은 본 논문에서 CEA 중 qEEG, SSEP, MEP를 이용한 INM을 통해 선택적으로 션트를 시행하여 뇌경색 발생을 성공적으로 예방할 수 있었던 두 증례를 보고하는 바이다. CEA 시에는 INM을 시행하여 뇌관류 증가가 필요한 환자에서 선택적으로 션트를 시행해야 하며, 한 가지 보다 여러 가지의 감시 도구(modality)를 동시에 사용할 것을 권장한다. 또한 반대편 경동맥질환이 있는 환자와 같이 뇌관류저하가 발생할 가능성이 높은 환자에서는 INM에 더 주의를 기울여야 하겠다.
