서론
뇌종양은 연령에 따라 다양한 유형으로 발생할 수 있다. 일차성 뇌종양은 소아에서는 배아/신경외배엽종양(embryonal/neuroectodermal tumor)과 털모양별아교세포종(pilocytic astrocytoma)이 가장 흔하며, 성인에서는 수막종(meningioma)과 악성 신경아교종(malignant gliomas)이 가장 흔한 원인이다[1]. 소아는 후두개와 종양(posterior fossa tumor)이 상대적으로 흔하지만, 성인은 천막상부 종양(supratentorial tumor)이 흔하다. 뇌종양 수술 시에는 운동경로와 감각경로를 포함한 다양한 신경경로와 뇌신경 및 신경핵의 손상이 발생할 수 있다. 수술중신경계감시는 이러한 손상을 줄이거나 예측하기 위해 뇌종양 수술에서 널리 사용되고 있다.
본 종설에서는 성인에서 흔한 천막상부 뇌종양 수술에서 주로 사용되는 수술중신경계감시 기법을 소개하고, 각 방법의 적절한 활용에 대해 논의하고자 한다.
본론
체성감각유발전위는 뇌종양 수술에서 척수후기둥-내측섬유대 경로(dorsal column-medial lemniscus pathway)의 손상을 감시한다. 이 경로는 촉각 구분, 진동, 고유감각을 매개하는 경로이다. 피부, 건, 근육의 수용체로부터 생성된 신호는 말초신경, 후근신경절, 척수후기둥을 거쳐 하부 연수의 설상핵(cuneate nucleus)과 널판핵(gracile nucleus)에서 첫번째 연접을 형성하고, 이후 연수에서 반대측으로 교차하여 내측섬유대를 거쳐 시상(thalamus)의 후외측복측핵에서 두번째 연접을 형성한 후 일차 체성감각피질로 전달된다. 그러므로 천막상부 뇌종양 수술에서는 일차 체성감각피질, 방사관(corona radiata), 내포(internal capsule), 시상 등이 체성감각유발전위의 변화에 연관된 주요 구조물이다.
상지는 정중신경 혹은 척골신경, 하지는 후경골신경을 자극하여 측정하며, 비복신경과 같은 순수감각신경의 자극으로는 측정이 어렵다. 천막상부 뇌종양 수술에서는 일차 체성감각피질에서 발생되는 근접부전위(near-field potential)인 N20(정중/척골신경)파와 P37(후경골신경)파의 변화를 측정하는 것이 중요하다. 이를 위해 기록 전극을 CP3, CP4, CPz, FPz 위치에 두고, 자극신경과 좌우 방향에 따라 적절한 몽타주로 기록하는 것이 일반적이나, 수술 절개부위가 해당 위치를 지날 경우 기록 전극을 최적의 위치에 두기 어려울 수 있다.
체성감각유발전위 감시에는 진폭(amplitude)과 잠시(latency)의 변화를 기준으로 사용한다. 수술 종류 및 위치와 무관하게 기저값에 비해 진폭의 50% 감소 혹은 잠시의 10% 증가가 가장 널리 받아들여지는 경고 기준(warning criteria)이다[2]. 실제 수술 중에는 체성감각유발전위 파형을 얻기 위해 100회 이상의 자극을 평균화 하기 때문에 손상으로 인한 변화에 다소 시차가 발생할 수 있으므로, 수술부위와 해부학적으로 연관된 변화로 의심된다면 경고 기준에 도달하기 전에 보고를 하는 것이 필요할 수 있다. 하지만, 체성감각유발전위의 경고 기준은 주로 척추측만증 교정술이나 척수수술에서 보고된 결과를 바탕으로 한 것으로, 이 기준이 천막상부 뇌종양 수술에서도 적절한지에 대한 근거가 많지 않다. Wiedemayer 등[3]은 다양한 신경외과 수술 사례에서 체성감각유발전위 감시의 위음성 결과에 대해 보고하였다. 그 중 대뇌반구 수술은 뇌종양 및 혈관수술을 포함하여 251건이었는데, 경증 및 중증의 신경학적 결손을 모두 포함하였을 때는 64%의 민감도와 95%의 음성예측도를, 중증의 신경학적 결손만 포함하였을 때는 81%의 민감도와 98%의 음성예측도를 보였다. Thirumala 등은 139건의 내시경공(endoscopic port)을 이용한 뇌내 및 뇌실내 종양 제거술의 결과를 바탕으로 체성감각유발전위의 수술후 신경학적 결손의 예측 가치를 민감도 83.3%, 특이도 95.5%, 양성예측도 45.4%, 음성예측도 99.2%로 보고하였다[4]. 하지만 두 연구 모두 감각결손뿐 아니라, 운동결손도 결과에 포함하였는데, 대뇌피질이나 방사관에서 운동경로 손상이 발생한 경우에는 해부학적 위치상 감각경로와는 거리가 떨어져 있어 체성감각유발전위 감시로는 감지가 되지 않으므로 신경학적 결손에 대한 민감도가 낮을 수밖에 없다. 천막상부 뇌종양 수술에서 감각결손에 국한하여 체성감각유발전위 감시의 예측 가치에 대한 연구가 필요하지만, 감각증상은 주관적인 경우가 많고, 정량적으로 측정하기가 까다로우며, 임상적으로 감각증상보다는 운동증상이 기능적 영향이 크기 때문에 이러한 연구가 수행되기가 어려운 것으로 보인다. 실제 임상에서는 운동유발전위와 함께 감시함으로써 예측 가치를 올릴 수 있다.
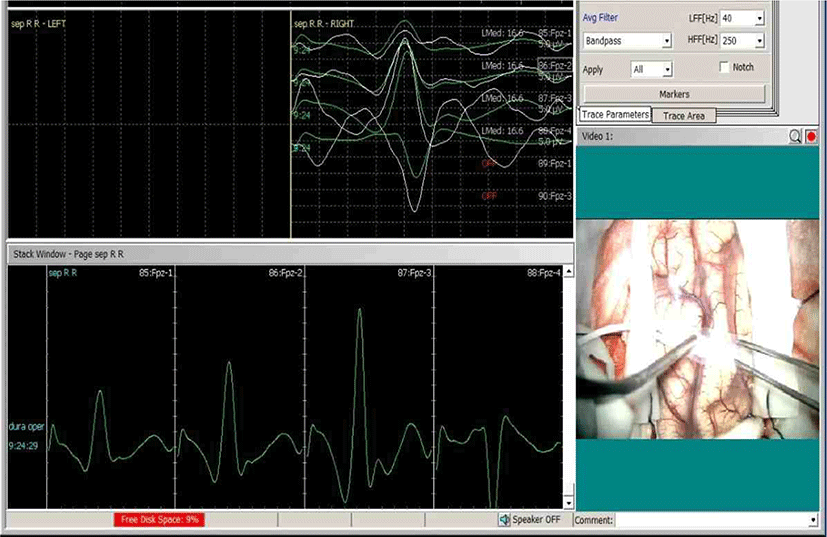
천막상부 뇌종양 수술에서는 정중신경 체성감각유발전위의 위상역전(phase reversal)을 이용하여 중심고랑(central sulcus)를 확인하는 매핑 방법도 사용된다(Fig. 1). 감각피질에 위치한 전극에서는 피질반응으로 N20파가 측정되며, 인접한 운동피질에 위치한 전극에서는 거울상인 P25파가 측정된다[5]. 띠전극(strip electrode)을 고랑을 가로지르도록 위치시키고, 반대측 정중신경을 자극하여 체성감각유발전위를 측정할 때 두 전극에서 역상이 형성되면 해당 전극 사이에 중심고랑이 있음을 알 수 있다. 이 방법은 종양에 의해서 중심고랑 주위의 해부학적 구조에 변화가 있을 때 특히 유용하다.
운동유발전위는 뇌종양 수술에서 피질척수로(corticospinal tract)의 손상을 감시한다. 이 경로는 대뇌의 일차운동피질과 일부 다른 보조적인 피질에서 시작하여 방사관, 내포, 대뇌다리(cerebral crus), 피라미드를 지나 척수로 내려가며 알파운동신경세포(alpha motor neuron)와 연접을 형성한다. 천막상부 뇌종양 수술에서는 대뇌피질, 방사관, 내포 등이 운동유발전위의 변화에 연관된 주요 부위이다. 이 부위의 손상을 감시하기 위해 경두개전기자극(transcranial electrical stimulation)과 직접피질자극(direct cortical stimulation)이 상호보완적인 자극방법으로 사용된다. 수술시 척수가 노출되지 않기 때문에 일반적으로 척수 경막외부에서 기록하는 D파형(D-wave)은 사용되지 않으며, 대부분 근육 운동유발전위(muscle MEPs) 를 기록하게 된다.
경두개전기자극은 두피 전극(scale electrode)이나 코르크따개 전극(corkscrew electrode)을 이용하여 두개골 외부에서 자극을 가하는 방법이다. 단상(monophasic) 자극은 양극(anode)에서 자극이 주로 유발되어 편측 피질척수로를 통한 운동유발전위를 기록하기에 적합하며, 이상(biphasic) 자극을 사용하면 양측에서 동일하게 자극을 유발하므로 양측 피질척수로를 통한 운동유발전위를 동시에 기록하기에 적합하다. 하지만, 최근 연구에 따르면 정전압자극(constant voltage stimulation)시에는 단상 자극에서도 양측에서 유발되는 운동유발전위에 차이가 없음이 보고된 바 있다[6]. 양측을 동시에 자극할 경우 대개 C3-C4 혹은 C1-C2 몽타주를 사용하며, 편측 자극시에는 C3-Cz 혹은 C4-Cz 몽타주를 사용한다. 양측 상하지에서 뚜렷한 반응을 얻기에는 C3-C4 몽타주가 유리하지만, 다른 자극 몽타주에 비해 대뇌의 심부에서 자극될 가능성이 높다는 단점이 있다. 경두개전기자극의 강도를 높일수록 척수에서 기록되는 D파형의 잠시(latency)가 짧아지는 현상이 보고되어 있으며, 특히 아주 높은 자극강도에서는 뇌간 자극시와 유사한 잠시가 측정되기 때문에, 결국 높은 자극 강도에서는 대뇌피질이나 그 인근의 피질척수로 손상을 놓칠 수 있다는 문제가 있다[7]. 일차운동피질에 인접한 뇌종양의 수술에서 경두개전기자극 운동유발전위 감시는 위음성 사례가 발생할 수 있음이 보고된 바 있다[8]. 그러므로, 뇌종양의 위치가 피질에 가깝다면 자극 강도를 가능한 낮추거나, C1-C2 혹은 C3/ C4-Cz 몽타주를 이용하여 심부에서 자극이 되는 것을 피하는 것이 필요하다. 혹은 아래 기술할 직접피질자극 운동유발전위를 함께 활용하여 손상 감시의 민감도를 높일 수 있다.
경두개전기자극 운동유발전위 감시는 주로 진폭의 변화를 기준으로 사용한다. 근육 운동유발전위의 진폭의 소실 혹은 50% 이상 감소가 주된 경고 기준이다[9]. 운동유발전위의 가변성으로 인하여 자극 시마다 파형의 형태와 진폭의 변동이 발생하는데, 만약 기준값의 변동폭이 50% 이상일 경우에는 50% 감소 기준을 적용하기 어렵기 때문에, 이런 경우에는 기준값과 비교하여 일관된 감소가 나타나는 것을 기준으로 한다. 뇌종양 수술에서 근육 운동유발전위의 변화가 없는 경우는 새로운 신경손상이 발생하지 않을 것으로 예측할 수 있다. 소실 혹은 감소가 발생하였으나, 수술 중 회복되는 경우에는 영구적인 신경손상은 드물고, 새로운 문제가 없거나 일시적인 결손이 나타나는 경우가 흔하다. 회복되지 않는 50% 이상의 진폭감소의 경우 영구적 혹은 일시적 결손이 나타나는 경우가 흔하며, 결손이 없는 경우는 드물다. 회복되지 않는 소실은 대부분 영구적인 신경손상으로 나타난다.
직접피질자극은 경막을 열어 노출된 일차운동피질 위에 띠전극과 같은 표면전극을 올려놓고, 이를 통해 직접 일차운동피질을 자극하는 방법이다. 일반적으로 체상감각유발전위의 위상역전을 이용하여 중심고랑을 찾은 후 일차운동피질의 매핑을 시행하여 전극 위치를 결정한다. 적절한 자극강도를 유지한다면 뇌 심부의 자극을 피할 수 있어, 피질에 인접한 종양의 제거시 운동경로의 손상 감시의 민감도를 높일 수 있다. 직접피질자극은 일반적으로 정전류자극(constant current stimulation)을 이용하며, 10–15 mA 정도면 충분한 자극이 가능하다[5]. 최적의 전극위치에서는 5 mA도 충분할 수 있으며, 전극의 위치가 최적이 아니거나, 마비가 있거나, 부분적인 근이완제의 사용 등의 방해요소가 있다고 하더라도 25–30 mA를 초과하는 경우는 거의 없다. 특히, 직접피질자극은 경련을 유발할 가능성이 있으므로 지나치게 높은 자극은 피해야 한다. 기술적인 편의에 따라 정전압자극을 이용하여 직접피질자극을 시행할 수도 있으며, 이 경우 저항의 변화에 따라 실제 가해지는 전류를 모니터링할 필요가 있다.
경고 기준은 운동유발전위의 진폭 감소 혹은 소실이 주로 사용된다. Seidel 등[10]은 돌연한 4 mA 이상의 자극역치의 증가와 운동유발전위가 소실되어 20 mA까지 자극 강도를 올렸음에도 측정되지 않는 경우를 경고 기준으로 정의한 바 있다. 수술 중에 자극전극의 접촉을 일정하게 유지하는 것이 중요하지만, 간혹 전극의 위치가 옮겨지거나 접촉이 유지되지 않아서 신경손상이 발생하지 않았음에도 운동유발전위가 감소하거나 소실되는 위양성 사례가 발생할 수 있다. 현재 진행 중인 수술부위를 고려할 때 신경손상보다 기술적인 문제가 의심된다면 수술자에게 전극의 위치 및 접촉을 확인하도록 요청해야 한다.
경두개전기자극과 직접피질자극의 장단점을 다음과 같이 정리할 수 있다. 경두개전기자극은 마취 유도부터 피부봉합 시까지 지속적으로 적용할 수 있다는 장점이 있으나, 환자의 움직임을 크게 유발하여 수술진행을 방해할 수 있고, 심부의 피질하 조직을 직접 자극하여 피질이나 주변 부위의 운동경로 손상을 감지하지 못할 수 있다. 직접피질자극은 국소적인 근육 활동만을 유발하여 움직임이 적고 일차운동피질의 표면 자극을 통해 피질 및 피질하 구조물의 손상을 민감하게 감시할 수 있다는 장점이 있다. 반면, 일차운동피질이 노출되는 수술에서만 사용이 가능하고, 운동피질이 노출되기 전과 경막을 닫은 이후에는 적용이 불가능하다는 단점이 있다[11]. 결국, 두 가지 방법의 장단점을 고려하여 적절하게 활용하는 것이 최적의 운동경로 손상감시를 위해 필요하다.
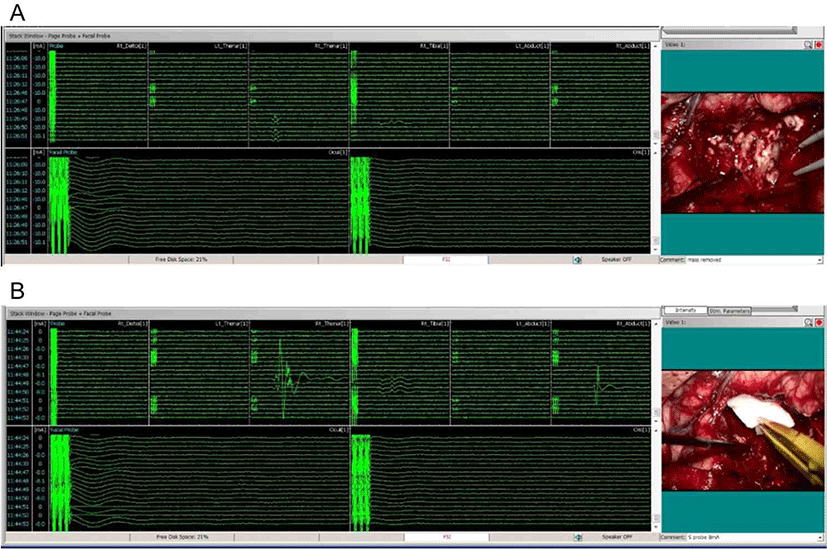
피질하자극은 뇌종양 수술중 피질척수로의 위치를 확인하기 위한 매핑 방법이지만, 수술부위로부터 피질척수로가 얼마나 인접한지를 평가할 수 있기 때문에 손상을 방지하기 위한 감시기법으로 활용할 수 있다. 손에 드는 자극기(handheld stimulator)를 이용하여 수술중 노출된 부위를 자극하였을 때 반대측 상하지에서 근육 운동유발전위가 측정되면 피질척수로가 인접하였음을 알 수 있다. 최근에는 수술중 지속적으로 피질하자극 매핑을 시행할 수 있는 전기자극이 가능한 흡인기(suction device)도 사용이 가능하다[12]. 피질하 백질 부위에서는 피질척수로가 넓은 영역에 퍼져 있어 그 중 일부의 신경섬유만 자극이 될 수 있으므로, 채널이 허용하는 범위에서 가능한 많은 근육에서 운동유발전위를 측정하는 것이 바람직하다. 단극성 자극(monopolar stimulation)을 주로 이용하며, 음극 자극(cathodal stimulation)이 자극 방법으로 더 적절한데, 이는 음극 자극시 자극 강도와 피질척수로까지의 거리 사이의 비율이 1:1에 더 가깝기 때문이다[13]. 그러므로, 10 mA에서 운동유발전위가 측정되었다면 해당 부위에서 피질척수로까지의 거리는 10 mm로 추정할 수 있으며, 피질척수로에 접근할수록 더 낮은 자극강도에서 운동유발전위가 측정된다. 처음에는 10–15 mA 정도의 자극 강도로 시작하여 운동유발전위가 측정되면 단계적으로 자극 강도를 낮춰가며 수술을 진행한다(Fig. 2). 안전한 경계는 자극역치 3 mA까지로 알려져 있으나, Seidel 등은 1 mA의 자극 역치를 보인 환자 4명 중 1명은 영구적 신경학적 결손이 발생하였고, 나머지 3명은 결손이 없었음을 근거로, 2 mA의 자극역치에서 종양 절제를 중단할 것을 권고한 바 있다[10]. 그러므로, 육안적 완전 절제(gross total resection)가 불가능하면 3 mA까지, 가능할 경우에는 1–2 mA까지 주의해서 접근하는 것을 고려할 수 있다. 만약, 충분한 거리를 유지하고 수술 진행하던 중에 운동유발전위가 유의미하게 감소 혹은 소실된다면, 혈관 손상이나 연축에 의한 허혈성 손상이 피질척수로에 발생한 것을 시사한다.
결론
천막상부 뇌종양에서 신경손상을 예방하기 위해서는 다양한 수술중신경계감시 기법을 복합적으로 활용하는 것이 중요하다. 체성감각유발전위와 경두개전기자극 운동유발전위는 대부분의 천막상부 뇌종양 수술에서 감각경로와 운동경로의 손상감시를 위해 기본적으로 사용될 수 있다. 이에 더하여, 일차운동피질에 가까운 종양의 수술 시에는 직접피질자극 운동유발전위를, 피질척수로에 가까운 종양의 수술 시에는 피질하자극을 함께 활용하는 것이 바람직하다. 천막상부에는 광범위한 뇌영역이 존재하기 때문에, 종양의 해부학적 위치와 현재 수술이 진행되는 위치를 지속적으로 확인하는 것이 각 감시방법의 변화를 적절히 해석하고 수술자에게 정확한 의견을 제시하기 위해 필수적이다.
