서론
별다른 감시장비가 없던 과거에는 의사가 환자의 상태를 평가하는 방법이 제한될 수밖에 없었다. 촉진, 청진 및 시각적인 관찰 등이 현재에도 유용하게 사용되나, 임상의사의 경험이나 실력에 따라 객관적인 평가 및 의사결정과정에서 결과가 달라지거나 효율이 떨어지는 등의 한계를 보인다. 최근 수십년간 마취감시장비는 급속도로 발전해왔다. 1980년대에 산소포화도, 심전도 및 호기말 이산화탄소 감시 등이 적용되었고, 1997년도에 마취심도를 나타내는 뇌파감시장비인 바이스펙트럼 지수(bispectral index, BIS) 장비가 도입되었다[1]. 2000년대 들어서 수많은 감시장비들이 개발 및 적용되고 있어 현재의 수술실에서의 마취형태는 과거와는 사뭇 달라졌으리라 생각된다.
현대 마취과학에서의 마취감시장비의 발전보다 더 빠르게 수술 중 신경계 감시(intraoperative neurophysiological monitoring, IONM)의 역사가 시작되었다. 이는 1930년대 후반 신경외과의사인 Penfield가 동료 Jasper와 간질수술에서 두개골을 열고 뇌파를 측정하였던 것이 그 시초로 보이며[2], Penfield는 그 후 간질파 병소를 찾기 위해 전기자극을 주기도 하였다. 1970년대에는 Brown이 척추측만증 교정수술에서 처음으로 체성감각유발전위검사(somatosensory evoked potential, SSEP)를 적용하였다[3]. 1980년도 이후, 디지털화된 유발전위와 뇌파를 본격적으로 다양한 신경계 수술 등 임상에서 적용하였다[4]. 특히 1992년 Scoliosis Research Society에서 IONM을 척추 수술 동안 wake up test의 보조수단으로 인정하였고, 대안적 이용도 가능하다고 결정하면서[5] 현재까지도 IONM이 표준 감시방법으로 사용되고 있다. IONM은 수술 중 신경생리학적 기록을 이용하여 신경계의 특정 부분의 기능을 연속적으로 평가하고, 수술로 인해 발생할 수 있는 신경손상으로 인해 결과가 변하는 것을 조기에 확인하여 수술 합병증을 줄이며, 고위험 수술을 안전하게 할 수 있도록 도움을 준다. IONM의 방법으로는 뇌파검사, 근전도검사, 유발전위검사 등이 널리 사용되고 있으며, 수술방법 및 환자 상태를 고려하여 위 검사들을 적절히 조합하여 이용하고 있다. 비록 IONM이 처음에는 수술의사 주도로 발전하였지만, 현재는 마취의사 및 관련 의료진 모두에서 환자 안전을 목적으로 하는 다른 마취감시장비들과 함께 통합적인 이해가 요구된다.
한편 마취약제에서도 많은 변화가 있었다. 과거에 널리 사용되던 흡입마취제인 halothane, enflurane, isoflurane 등은 현재 임상에서 찾아보기 어렵고, 현재는 desflurane, sevoflurane, nitrous oxide 정도의 흡입마취제가 사용되고 있다. 정맥마취제 또한 그 종류가 매우 많음에도 현재 임상에서 사용되는 것은 극히 일부분이다. 예를 들어 IONM 적용시에 propofol과 remifentanil 조합의 전정맥마취(total intravenous anesthesia, TIVA) 방법이 많이 사용되고 있고, 이 방법이 대부분의 경우에서 무리없이 적용이 가능하다. 그러나 이것이 과연 이상적인 마취방법이 맞는지에 대해서는 깊은 고민이 필요하겠다.
이에, 여기에서는 마취에 초점을 두고, 신경계감시 측면에서 마취 관리에 요구되는 기본 배경지식 및 고려할 점을 소개하고자 한다.
본론
수술 중 마취의 목적은 원활한 수술 진행과 환자의 안전관리의 두 가지 측면으로 생각해볼 수 있다. 수술과정에서 발생할 수 있는 이환율과 사망률을 감소시키기 위해 수술에 앞서 적절한 환자평가와 마취계획의 수립을 수행한다. 이 때 최소 진정, 중등도 진정, 깊은 진정 혹은 전신마취 등 수술에 요구되는 마취의 깊이도 충분히 고려되어야 한다. 깊은 진정 이상의 경우 전문기도관리가 필요할 수 있으며, 중등도 이하의 진정에서는 보통 환자의 자발 호흡 및 심혈관기능이 유지된다[6].
전신마취 중에는 의식 소실, 감각 소실, 근이완의 필요 정도에 따라 알맞은 약물을 조합하여 사용하게 되며, 마취의 유도 및 유지 기간 동안 모두 정맥마취제를 사용한 경우를 TIVA, 모두 흡입마취제를 사용한 경우 VIMA(volatile induce and maintenance anesthesia), 흡입마취제 및 정맥마취제를 사용한 경우 balanced anesthesia라고 부른다[7].
수술 중 신경계 감시장비 중 유발전위검사는 SSEP, 운동유발전위(motor evoked potential, MEP)가 많이 사용되는데, 비정상적인 경우 유발전위의 진폭(amplitude)이 감소하고, 잠복기(latency)가 증가하는 소견을 보인다. 수술 중 원활한 신경계 감시를 위해서는 적절한 환자 생리와 마취심도를 유지하는 것이 필수적이다.
전신적 혹은 국소적인 혈압의 감소는 뇌혈류를 감소시켜 뇌파 및 유발전위 검사결과에 영향을 미칠 수 있다[8]. 환자에 따라 뇌혈류의 auto-regulation이 유지되는 혈압의 범위가 다르므로[9] 취약한 환자일수록 더욱 주의를 기울여야 한다. 또한 혈압이 정상이어도 수술 중 손상이나 잘못된 자세로 인해 국소적 척수허혈이 발생한 경우 비정상적인 결과를 보일 수 있다[10].
혈중 산소분압 및 이산화탄소 분압을 적절하게 유지하여야 한다. 저산소화 자체가 신경계감시 소견에 영향을 주며[11] 부적절한 환기로 인한 산소분압의 저하는 뇌조직 및 신경계의 파괴를 일으킬 수 있어 마취유도 및 유지기간동안 적절한 기도관리가 중요하다. 또한 혈중 이산화탄소 분압의 변화는 뇌혈류의 변화를 일으키므로 과도한 과환기나 저환기를 피해야 한다[12]. 진정 중에 대부분의 마취제가 환기를 저하시키기 때문에 기계적 환기가 필요할 수 있다.
전신마취 중에는 마취제가 시상하부의 체온조절 중추를 억제시켜 저체온이 호발한다[13]. 부위마취 시에도 혈관확장에 의한 저체온이 발생가능하다[14]. 저체온 또한 뇌파 및 유발전위 검사결과에 유의한 영향을 미치므로[15] 적절한 체온관리가 필요하다.
마취감시장비를 목적에 따라 분류하면 다음 세 가지로 나타낼 수 있다.
-
환자 안정성 감시: 청진, 심전도, 혈압, 맥박, 소변량, 체온, 심박출량, 혈색소, 산소화(맥박 산소 측정기, 혈중산소분압 및 oxygen reserve index), 뇌내 산소 포화도 모니터링 등
-
마취 정도의 측정: 흡입마취제의 호기말 농도, 근이완 감시(사연속자극; train of four, TOF), 뇌파감시
-
장비 성능: disconnect 알람
이 중 마취영역에서의 뇌파감시는 IONM의 뇌파감시와 목적이 다른 부분이 있다. 환자의 이마에 뇌파 센서를 부착하여 뇌 전도의 빈도, 진폭 및 간섭성의 지표를 통계학적으로 측정하여 숫자(뇌의 활성도가 없는 경우 0, 완전한 각성상태 100)로 표시하고, 전신 마취 및 진정의 깊이를 평가한다. 이러한 뇌파감시장비는 마취제의 과도한 사용을 줄이는 장점이 있어 널리 사용하고 있다. 특히 정맥마취제의 경우 개인간 차이가 흡입마취제보다 상대적으로 크기 때문에 뇌파감시장비의 사용이 강하게 추천된다[24,25]. 수술부위 등의 이유로 이마에 센서부착이 어려운 경우에는 환자의 턱 등 다른 부위에 붙여 사용하는 방법도 제시되고 있다[26]. 하지만 표준 부위에서 멀어질수록 뇌파의 주파수에 따라 도달하는 세기가 다르고, 목근육의 근전도 등이 간섭하여 부정확한 결과를 보이는 경우가 보고된다[27]. 현재 BIS 외에도 Entropy, Sedline 등 많은 종류의 장비들이 사용되고 있으며, 장비에 따라 알고리즘이 각각 다른 부분이 있으나[28], 임상에 적용하는 것에는 큰 차이나 어려움이 없다.
현재 임상에서 상용하고 있는 흡입마취제는 휘발성 마취제인 desflurane, sevoflurane과 비휘발성 흡입마취제인 N2O로 나뉜다. 휘발성 마취제는 용량 의존적으로 synaptic activity를 억제하여 SSEP 및 MEP의 정상적인 반응을 억제한다[29]. 특히 MEP의 억제가 심하여 0.5 minimum alveolar concentration(MAC) 이상의 흡입마취제 농도를 피하는 것이 좋다[30,31]. 고용량의 흡입마취제 사용시에는 유발전위검사가 어렵고, 저용량 사용시에도 신경질환이 있거나 흡입마취제를 오래 사용하게 되면 유발전위결과가 억제되어 신경계 감시를 어렵게 한다[32]. N2O는 다른 흡입마취제와 작용기전은 다르지만, 다른 마취제와 함께 사용시 역시 유발전위의 진폭을 감소시키는 것으로 알려져 있다[33,34]. 일부 연구들은 balanced anesthesia로 다른 정맥마취제 등과 함께 흡입마취제를 저용량으로 사용하여 성공적인 신경계 감시를 시행한 결과들을 보여주고 있으나, 흡입마취제가 신경계감시에 단점을 가지고 있음은 주지하고 있어야 하겠다.
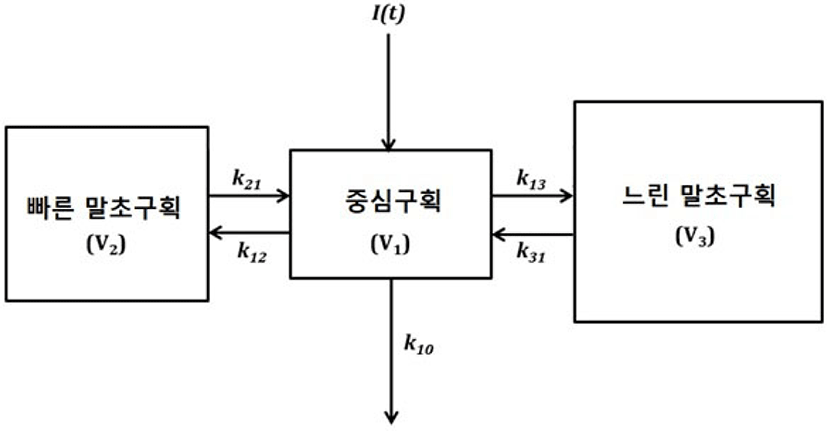
약동학적 관점에서 정맥으로 약물투여 후 시간에 따른 혈중농도의 변화를 예측할 수 있는데, 약물의 배치함수가 일차역학으로 exponential decay를 보인다면 Cp(t) = C · e−λ · t의 식으로 나타낼 수 있다. 하지만 propofol의 혈중농도의 실제 변화는 위의 식보다는 초기에는 혈중농도가 더욱더 급격하게 감소하는 Cp(t) = C1 · e−λ1 · t + C2 · e−λ2 · t+ C3 · e–λ3 · t의 식에 더 가까운 형태를 보이게 된다. 후자의 식은 구획모형의 하나인 삼구획 약동학모형[35]으로 설명 가능하다. 이는 체내를 개념적인 세 개의 구획, 중심구획, 빠른 말초구획, 느린 말초구획으로 나누고(Fig. 1), 혈중농도의 감소를 빠른 분포기, 느린 분포기, 제거기로 나타낸다. 실제로 대부분의 정맥마취제들은 정맥내 투여된 후 분포로 인해 효과가 소실되어 작용 시간이 짧다. 즉, 약물의 대사로 인해 효과가 사라지는 것이 아니라, 효과처에서 약물농도가 감소하여서 마치 약물의 효과가 없는 것처럼 보이는 것이다. 마취제를 지속적으로 투여할 경우, 약제가 말초 용적에 축적되어 회복이 지연되는데, 이를 상황민감성 반감기로 설명한다. 여기서 상황이라는 단어는 주입기간을 의미하며, 예를 들어 thiopental은 상황민감성 반감기의 변화가 큰데, 마취유도용량으로는 20분만에 각성이 가능하나, 지속적으로 투여할 시 수시간이 지나도 잘 깨지 않는 현상을 보인다. 즉 thiopental을 마취유지용으로 반복사용하는 것은 부적절하다는 뜻이다. Propofol은 thiopental이나 midazolam에 비해 상황민감성 반감기의 변화가 크지 않아 마취유지용으로 사용하는 데 큰 무리가 없다[36]. 또한 과거의 low chain triglyceride의 propofol 제형에 비해 비교적 최근에 middle chain triglyceride 제형의 propofol이 개발되면서 정주통증, 이상지질혈증 등의 부작용이 개선되었다[37].
Propofol보다 상황민감성 반감기가 적은 최면약제는 etomidate가 있으나, 부신피질억제의 위험 등의 부작용이 보고되었다[38]. 최근에 벤조디아제핀 계열이면서 상황민감성 반감기의 변화가 적은 remimazolam이 출시되어 추후 임상연구가 기대된다.
Propofol은 진통작용이 없기 때문에 아편유사제인 remifentanil을 함께 사용하는 경우가 많다. Remifentanil은 예외적으로 혈액 및 조직에서 비특이적 에스터라제에 의해 빠르게 분해되기 때문에 상황민감성 반감기가 주입기간에 상관없이 3분 정도로 변하지 않아 지속주입용도로 사용하기에 유용하다[39].
한편, 위에 서술한 약동학적 수식과 모형을 이용하여 목표농도조절주입이 가능한데, 원하는 효과처 농도를 설정하면 컴퓨터가 자동으로 초기 용량과 연속주입속도를 계산하여 주입하게 된다[40]. 현재 Propofol의 Marsh 혹은 Schnider 모형과 remifentanil의 Minto 모형이 임상적으로 널리 쓰이고 있다.
대부분의 정맥마취제는 휘발성 흡입마취제에 비해서 유발전위검사에 미치는 영향이 작다. 과거의 문헌들이 일치된 결론을 나타내지는 않지만, propofol의 경우 임상용량에서 유발전위검사의 감시가 용이하며, 고용량에서 MEP를 감소시키는 것으로 보인다[41,42]. Thiopental은 고용량에서도 SSEP가 유지된다는 보고가 있으나[43], SSEP, MEP를 모두 억제한다[44,45]. Midazolam 역시 SSEP 감시에서 잠복기를 연장시키는 등의 단점이 있으나, 마취전투약 목적의 적은 용량 정도로는 MEP나 SSEP에 영향을 덜 미치는 것으로 보인다[45]. Etomidate의 경우 SSEP에서 진폭을 증가시킨다는 보고가 있고, ketamine도 SSEP와 MEP의 진폭을 증가시키는 등 신경계감시에서 장점을 가진다[45]. 과거에는 ketamine이 두 개내압 상승을 일으킬 수 있어[46,47] 유발전위의 진폭을 감소할 수 있다고 생각되었지만 최근 연구들에서는 안전하다는 결과가 보고되고 있다[48–50]. 비교적 최근에 개발된 알파2작용제인 dexmedetomidine 역시 MEP에 영향을 미칠 수 있으나[51], 다른 마취제와 함께 사용하여 성공적인 신경계감시 결과를 보이고 있다[52]. Dexmedetomidine은 propofol 등과 달리 임상용량에서 호흡저하를 일으키지 않아 수술 중이나 수술 후 중환자실 진정에서 널리 사용되고 있다[53]. Fentanyl, remifentanil 등의 아편유사제는 유발전위에 영향을 크게 미치지 않아 실제로 환자의 혈역학적 상태가 안정적이면 큰 제한없이 사용되고 있다[54]. 마취제들이 직접적으로 IONM에 영향을 미치는 경우도 있지만, 환자 생리를 변화시켜 간접적으로도 영향을 미칠 수 있음을 항상 고려해야 한다.
앞서 소개하였던 remimazolam은 midazolam과 유사한 특성이 기대되고 MEP 감시에서 성공적으로 사용된 증례보고[55]가 있으나, 아직까지는 임상에서 유발전위검사에 미치는 영향이 제대로 알려져 있지 않다. 이외에도 현재 개발 중인 약제로는 프로게스테론 유사체인 phaxan, etomidate의 유사제인 ABP-700, propofol의 전구약물인 fospropofol 등이 있다.
신경근 차단제는 기관삽관을 용이하게 하고, 수술 중 주마취제의 용량을 줄여도 환자가 움직이지 않게 하여 마취심도를 상대적으로 얕게 유지할 수 있게 한다. 과거에는 근이완제로 불리었으나 근육의 경련 또는 긴장 시 이완 목적으로 사용되는 중추성 근이완제와 혼동하여 환자에게 심각한 위해가 발생하는 경우들이 보고되어, 현재는 신경근 차단제로 통일하여 부르고 있다. 신경근 차단제는 신경근접합부에 작용하여 근이완을 발생시키며, 작용기전에 따라 탈분극성 혹은 비탈분극성 신경근 차단제로 나누고 있다. 탈분극성 신경근 차단제로는 succinylcholine이 있으며, 아세틸콜린과 같이 탈분극을 일으킨 후 지속적인 탈분극을 유지하여 근이완을 유발한다. 일회 사용시 지속시간은 보통 10분 이내로 짧으나, 수차례 사용하거나 연속적으로 사용시 탈감작반응으로 이온통로가 닫히게 되는 2상 차단이 발현되어 근이완회복시간이 상당히 지연되면서 근이완회복의 예측이 어렵다. 따라서 succinylcholine은 보통 기관내삽관 시 단회 정주로 사용된다[56]. 한편, succinylcholine은 두개내압의 일시적 상승, 혈중 칼륨수치의 상승 등의 단점이 있어 임상에서의 사용이 많이 줄었다. 비탈분극성 신경근 차단제는 아세틸콜린이 아세틸콜린 수용체와 결합하는 것을 경쟁적으로 방해하여 근이완을 유발시키며, benzylisoquinolium 계열의 atracurium, cisatracurium 및 steroidal 계열의 vecuronium, rocuronium 등이 사용되고 있다. 현재 사용하는 비탈분극성 신경근 차단제들은 작용시간이 succinylcholine보다는 길지만 비교적 작용이 빠르고 지속시간이 짧은 편으로 기관삽관이나 수술 중 안전하게 사용되고 있다. 특히 비교적 최근에 출시된 sugammadex는 steroidal 계열의 신경근 차단제(특히 rocuronium)를 빠르게 길항시켜, 필요시 수술 신경계 감시를 위해 원치 않는 근이완 효과를 용이하게 제거할 수 있다[57]. 수술 중 근이완의 정도를 평가하는 방법은 여러가지가 있으나, 비탈분극성 신경근 차단제 사용시 널리 사용하는 방법으로 TOF가 있다. TOF는 척골신경에 2초간 4번의 자극을 주어 반응의 개수를 세고(0–4개), 4개의 TOF 반응이 있을 때는 첫 번째 수축에 대한 네 번째 수축의 비율로 평가한다(ratio 0%–100%).
신경근 차단제는 EMG 및 MEP를 상당히 감소시키기 때문에 수술 중에 피하는 것이 좋으나, 필요하다면 소량을 사용하게 되며, 단회 정주가 아닌 지속적인 정주로 사용하는 것이 좋겠다. 수술 중 근이완 감시를 시행하여 TOF 2개 이상으로 유지하는 것이 추천된다[58]. 반대로 SSEP 단독 감시 중에는 신경근 차단제의 사용이 EMG 간섭을 줄이기 때문에 신경근 차단제의 충분한 사용이 도움이 될 수 있다.
IONM의 방법을 흡입마취제 및 신경근 차단제의 영향에 따라 구분할 수 있다. 흡입마취제 및 신경근 차단제에 모두 영향을 받는 transcranial MEP의 경우, barbiturate를 피하면서 TIVA를 적용하고 적절한 감시장비하에 신경근 차단제를 필요시에만 사용하는 것이 추천된다. 흡입마취제에 영향을 받고 신경근 차단제의 영향을 받지 않는 SSEP, AEP 등은 0.5 MAC 이하의 흡입마취제나 정맥마취제를 사용하고, 충분한 신경근 차단제를 사용할 수 있다. 마지막으로 BAEP나 epidural/perispinal evoked potential의 경우는 마취제의 영향이 적기 때문에 흡입마취제, 정맥마취제, 신경근 차단제의 선택 및 사용이 좀 더 자유롭겠다.
최근의 논문들은 수술 중 신경계 감시에서 수술의사, 마취과의사, 신경과의사, 임상병리사 및 간호사 등 관련 의료진들의 유기적이고 포괄적인 접근이 효과적임을 보여주고 있다[59,60]. IONM에서 이상신호를 발견하였을 때 이것이 병적인 반응인지를 평가하기 위해서는 환자 요인, 수술적 요인, 마취 요인 등 많은 것을 고려해야 한다. 수술 전부터 수술의사와 마취의사의 원활한 의견교환을 통해 위험요인을 평가하고, 적절한 마취계획 및 감시계획을 세우는 것이 중요하다. 팀구성원 각각이 IONM에 대한 깊은 이해를 가지고 이상신호에 대해 빠르게 대처해야 하며, 이러한 팀이 유지될 수 있도록 효율적인 알고리즘과 시스템을 구축하는 것이 필요하다[60]. 이러한 노력들은 궁극적으로 환자의 안전과 예후에 좋은 영향을 미칠 것으로 생각된다.
