서론
수술중신경계감시는 수술 중 신경계 손상을 조기에 발견하거나 수술 중 손상가능성이 높은 신경부위의 정확한 위치를 파악하여 수술 후 발생하는 신경학적 합병증 및 장애의 위험성을 최소화하고자 시행한다[1]. 수술중신경계감시는 다양한 신경생리검사를 응용하여 중추신경계 및 말초신경계의 여러 신경부위를 감시하게 된다. 일반적으로 운동유발전위, 체성감각유발전위, 뇌간청각유발전위, 시각유발전위, 뇌파 및 근전도를 이용하며, 병변의 위치에 따라 적절한 신경생리검사를 선택하여 검사를 시행하게 된다.
뇌하수체종양은 해부학적으로 시신경교차(optic chiasm)와 인접해 있으며, 종양의 크기에 따라 시신경 및 시신경교차를 압박하기도 한다. 뇌하수체 종양 수술은 접근방법에 따라 크게 나비뼈경유접근법(transsphenoidal approach)과 경두개접근법(transcranial approach)이 있다[2]. 뇌하수체 종양 수술의 주요 합병증으로 뇌척수액누출, 수막염, 뇌졸중 및 시야장애 등이 있으며, 약 3.4% 빈도로 보고되었다[2]. 뇌하수체 종양의 수술 시 발생할 수 있는 시야장애 및 시력 소실 등 신경학적 합병증을 예방하기 위해 시각유발전위를 이용하여 수술중신경계감시를 시행할 수 있다. 최근 검사기법 및 마취제의 발달로 시각유발전위의 유용성이 점차 높아지고 있다. 이에 본 저자들은 뇌하수체종양 수술에서 시각유발전위를 활용하여 수술중신경계감시를 시행한 증례를 보고하고, 수술중신경계감시에서 시각유발전위의 유용성에 대해 고찰해 보고자 한다.
증례 1
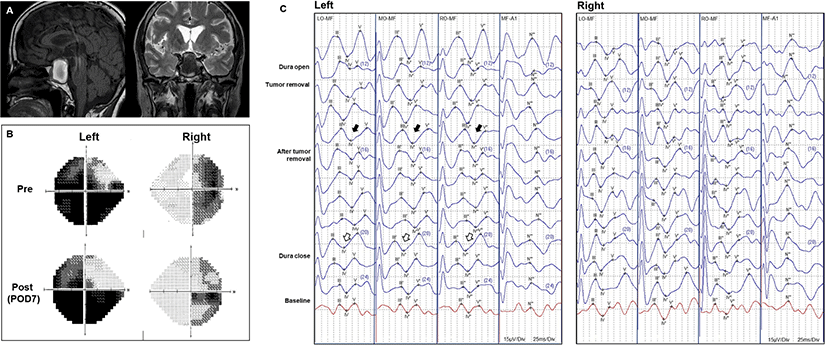
특이병력이 없는 65세 여자가 전신 무력감을 주소로 응급실로 내원하였다. 시행한 검사에서 저나트륨혈증 소견이 보였으며, 간헐적으로 의식의 혼동(confusion)을 보여 감별진단을 위해 뇌 자기공명영상검사를 시행하였다. 시행한 뇌자기공명영상에서 안장위영역에서 2.8 cm 크기의 종괴가 관찰되었다(Fig. 1-A). 상기 소견에 대하여 나비뼈경유수술을 통한 종양제거술을 시행하였다. 수술 전 시행한 험프리 시야검사에서 양귀쪽반맹(bitemporal hemianopsia) 및 좌안의 내측 하방부 시야결손 소견이 관찰되었으며(Fig. 1-B), 광자극 시각유발전위검사(visual evoked potential)에서는 좌측의 Wave IV의 잠복기 지연소견이 관찰되었다. 마취는 프로포폴(propofol) 2–8 μg/mL와 레미펜타닐(remifentanil) 4–8 ng/mL를 사용하여 완전정맥마취(total intravenous anesthesia)를 시행하였다. 수술중신경계감시는 뇌파, 체성감각유발전위 및 시각유발전위를 시행하였으며, Cadwell Cascade Elite(Cadwell Industries, Washington, DC, USA) 장비를 이용하여 검사하였다. 체성감각유발전위는 상지에서는 정중신경(median nerve)에서 자극하고, C3’-Fz, C4’-Fz에서 측정하였으며, 하지에서는 뒤경골신경(posterior tibial nerve)에서 자극하고, Cz’-Fz 전극에서 측정하였다. 자극 빈도는 2.82 Hz로 시행하였고, 평균화 횟수는 200번으로 하였다. 뇌파는 C3, C4, Fz, Cz, LO, MO, RO, MF 전극을 이용하여 측정하였다. 시각유발전위는 고글을 이용하여 섬광자극을 주었으며, LO, MO, RO, A1-MF의 4채널 전극에서 기록하였다. 섬광자극의 빈도는 1.05 Hz이며, 주파수 폭(band-pass)은 High-pass filter는 70 Hz, Low-pass filter는 1 Hz로 설정하고, 평균화 횟수는 100번으로 설정하였다. 체성감각유발전위 및 시각유발전위의 진폭이 50% 이상 감소 또는 잠복기가 10% 이상 지연되는 경우를 유의한 변화로 간주하였다. 전체 수술 기간 동안 뇌파, 체성감각유발전위 및 우측 시각유발전위에서 유의한 변화는 관찰되지 않았다. 종양을 제거하면서 초기에는 시각유발전위에서 변화가 없었으나, 종양의 제거가 거의 끝나기 직전 좌측 시각유발전위의 wave IV의 잠복기가 baseline과 비교하여 약 18% 정도 지연되는 소견이 관찰되었다. 시각유발전위의 진폭은 유의미한 변화는 관찰되지 않았다. 종양 제거가 종료된 이후에도 시각유발전위의 잠복기 지연 소견은 지속되었으며 약 40여 분 지속되고 나서 다시 baseline 수준으로 회복되었고, 수술은 종료되었다(Fig. 1-C). 수술 후 환자가 느끼는 주관적인 시야호전 양상은 없었으며, 시야검사에서도 이전과 비슷한 양상의 시야결손 소견이 보이나 수술 전과 비교하여 다소 호전된 양상이었다. 또한, 수술 후 시행한 시각유발전위 결과, 좌측 wave IV의 잠복기는 수술 전과 비교하여 호전된 양상을 보였다.
증례 2
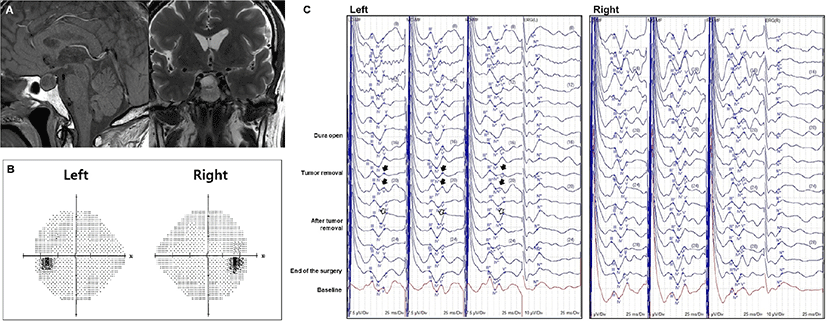
편도암의 기왕력이 있는 64세 남자 환자가 추적관찰 중 발견된 뇌하수체 종양에 대해 수술적 치료를 위해 내원하였다. 뇌 자기공명영상에서 뇌하수체에서 약 1.7 cm 크기의 종괴가 관찰되었다(Fig. 2-A). 상기 소견에 대하여 나비뼈경유수술을 통한 종양제거술을 시행하였다. 수술 전 험프리 시야검사를 시행하였으며, 이상소견은 발견되지 않았고(Fig. 2-B), 수술 전 시행한 광자극 시각유발전위에서는 양측 wave IV의 잠복기가 지연된 소견이 관찰되었다. 마취는 프로포폴 2–8 μg/mL와 레미펜타닐 4–10 ng/mL를 사용하여 완전정맥마취를 시행하였다. 수술중신경계감시는 뇌파, 체성감각유발전위 및 시각유발전위를 시행하였으며, Cadwell Cascade Elite(Cadwell Industries, Washington, DC, USA) 장비를 이용하여 검사하였다. 체성감각유발전위는 상지에서는 정중신경에서 자극하고, C3’-Fz, C4’-Fz에서 측정하였으며, 하지에서는 뒤경골신경에서 자극하고, Cz’-Fz 전극에서 측정하였다. 자극 빈도는 2.82 Hz로 시행하였고, 평균화 횟수는 200번으로 하였다. 뇌파는 C3, C4, Fz, Cz, LO, MO, RO, MF 전극을 이용하여 측정하였다. 시각유발전위는 고글을 이용하여 섬광자극을 주었으며, LO, MO, RO, A1-MF의 4채널 전극에서 기록하였으며, 망막전위도검사(electroretinography)도 함께 시행하였다. 섬광자극의 빈도는 1.05 Hz이며, 주파수 폭은 High-pass filter는 70 Hz, Low-pass filter는 1 Hz로 설정하고, 평균화 횟수는 100번으로 설정하였다. 체성감각유발전위 및 시각유발전위의 진폭이 50% 이상 감소 또는 잠복기가 10% 이상 지연되는 경우를 유의한 변화로 간주하였다. 시각유발전위는 수술 시작 시 정상적으로 파형이 형성되었으나, 종양제거술을 시작하면서 좌측 시각유발전위 중 RO 전극에서 측정된 파형의 진폭이 50% 이상 감소하는 소견이 보였고, 5분 정도 지속되다가 호전되었다(Fig. 2-C). 이후 수술 후 시각유발전위의 유의미한 변화는 없었다. 전체 수술 기간 동안 체성감각유발검사 및 뇌파에서도 유의미한 변화는 관찰되지 않았다. 수술 후 시야증상을 포함한 신경학적 이상소견은 관찰되지 않았다.
고찰
본 증례들은 뇌하수체종양에서 시각유발전위를 이용하여 수술중신경계감시를 시행하였던 증례이다. 첫 번째 증례에서는 수술 중 유의미한 진폭의 변화는 보이지 않았으나 wave IV의 잠복기가 일시적으로 지연되었던 소견이 관찰되었으며, 두 번째 증례에서는 일시적인 시각유발전위의 진폭이 감소되었다가 회복된 소견이 관찰되었다. 두 증례 모두 수술 후 유의미한 시각장애는 보이지 않았다.
시각유발전위는 시각경로의 이상여부를 확인할 수 있는 유용한 검사로, 시각 자극에 대한 전기생리학적 파형을 후두엽이나 시각피질영역에서 기록하게 된다[3]. 시각유발전위는 시각경로에 손상을 줄 수 있는 수술에서 활용할 수 있으며, 눈동맥의 동맥류(ophthalmic aneurysm), 뇌전증수술, 뇌하수체종양, 시각로(optic tract) 인접한 종양이나 시각피질에 인접한 종양 등을 수술하는 경우에 적용해볼 수 있다. 시각유발전위는 불안정성 및 낮은 재현성으로 인해 널리 활용되지 못하였으나, 최근 광자극 방법의 개선, 망막전위도검사의 활용, 마취제의 발달로 수술 중 시각유발전위의 파형의 안정성 및 재현성이 향상되었다. 시각유발전위에서 적절한 광자극은 안정된 파형을 획득하는데 중요한 요소이다. 최근에는 LED를 이용한 높은 강도의 광자극을 통해 안정적이고 재현성이 높은 파형을 보여준 연구결과들이 발표되었다[4,5]. 또한 망막전위도검사를 함께 시행하면 광자극이 망막에 제대로 도달하였는지 확인하는 데 도움이 된다. 망막전위도검사는 양쪽 외안각(lateral canthus)에 전극을 위치시켜서 측정한다. 시각유발전위 파형이 잘 형성되지 않았을 때, 망막전위도파형이 잘 형성되지 않는다면 충분하지 않는 빛자극으로 인해 시각유발전위 파형이 영향을 받은 것으로 생각해볼 수 있다. 시각유발전위에 영향을 주는 또다른 요인은 마취제이다. 시각유발전위는 흡입마취제에 큰 영향을 받는다. 흡입마취제는 시각유발전위의 진폭을 감소시키며, 마취제의 농도가 높은 경우에는 파형이 소실될 수 있다[6]. 정맥마취제 중 프로포폴, 펜타닐, 레미펜타닐은 시각유발전위에 영향이 적은 마취제이며[7], 따라서 완전정맥마취를 시행하는 것이 권고된다. 이외에도 수술 전 시각 기능의 장애가 심한 경우에는 시각유발전위의 파형의 재현성이 낮아질 수 있다.
시각유발전위에서 N75와 P100 사이의 peak-to-peak 진폭이 50% 이상 감소한 경우를 유의미한 변화로 생각하며, 파형이 소실되고 수술 종료 시까지 회복되지 않는 경우에는 수술 후 심한 시야장애가 남을 가능성이 높다. 이전에 보고된 연구에서는 수술 후 시각 장애에 대한 시각유발전위의 민감도 25%–100%, 특이도 85%–100%, 양성예측도 50%–100%, 음성예측도 93%–100%로 보고되었다[8]. 시각유발전위 파형의 진폭이 50% 이상 감소된 경우를 주의징후(warning sign)로 여기는 데 비하여, 시각유발전위 잠복기의 지연에 대해서는 아직까지 명확한 기준은 없다. 이전 문헌에서 수술 중 시각유발전위의 잠복기 지연소견이 관찰되었고, 수술 후 환자의 시각 장애가 동반되었던 증례가 보고되었다[5]. 하지만, Feng 등은 시각유발전위의 진폭의 변화는 시야장애 여부와 관련성이 높지만, 시각유발전위의 잠복기는 유의미한 연관성이 보이지 않는다고 보고하였다[9].
결론적으로, 뇌하수체종양 수술에서 시각유발전위는 시각경로를 감시하는 데 유용한 검사이다. 이를 통해 수술 중 시각경로의 이상여부를 조기에 감지하고, 수술의 시각장애를 예방하는 데 도움을 받을 수 있다. 시각유발전위의 진폭이 50% 이상 감소하는 경우는 수술 후 신경학적 장애가 발생할 가능성이 높은 주의징후이다. 하지만, 잠복기 지연에 대해서는 아직까지 명확한 기준은 없다. 향후 시각유발전위 잠복기 변화의 임상적 의미에 대해서는 더 많은 연구가 필요할 것으로 생각된다.
