서론
척추 수술 중 특히 척수 수술은 신경계 손상의 위험성이 크며, 때로는 불가피할 경우도 있는데, 수술 후 심각한 운동 및 감각 결손을 초래할 수 있다[1]. 이러한 수술 중의 비가역적인 신경 손상을 피하고 최소화하기 위해 최근 약 30년간 신경생리학적 감시 기법이 연구되어 발전하였고, 척수 수술에서 다양한 장비를 이용하여 운동계, 감각계 및 반사로의 실시간 감시가 가능하게 되었다. 신경계 손상의 위험이 높은 척수 수술의 경우에는 특히 이러한 수술중신경계감시(intraoperative neurophysiological monitoring, IONM)의 역할이 매우 중요하다. 본 종설에서는 척수 수술에서 IONM의 기법과 유용성에 대한 최근 연구를 정리하고, 검사 결과의 해석에 대해 고찰하고자 한다.
본론
척수 수술 중 신경계 감시의 목적은 1) 수술 중 척수절개 시 신경 손상을 최소화할 수 있는 이상적인 해부학적 랜드마크를 제공할 수 있으며, 2) 수술 후 신경계 장애를 최소화할 수 있는 이상적인 절제경계(resection margin)를 정하는 데에 정보를 제공하며, 3) 수술 중 신경 손상을 실시간으로 감지할 수 있고, 4) 수술 후 단기 및 장기적인 신경계 기능의 예후를 추정하는 데에 있다.
척수 수술에서 가장 기본적으로 널리 쓰이는 IONM 검사 기법은 체성감각유발전위(somatosensory evoked potential, SSEP), 운동유발전위(motor evoked potential, MEP), 근전도(electromyography, EMG) 및 망울해면체근반사(bulbocavernous reflex, BCR) 감시 등이 있다[2,3]. 특히 SSEP와 MEP는 Level I 권고사항으로 척수 및 척추수술에서 강력히 권고되고 있다[4]. Level I 권고사항은 기존 연구의 Class of evidence를 종합하여 전문가 집단에서 제시한 것이고, Class I evidence는 무작위 비교연구 또는 이러한 연구의 체계적 문헌고찰 연구를 의미한다. 그 외에도 특히 척수내 수술의 경우 척수 지도화(spinal cord mapping) 검사가 이루어진다[3].
SSEP는 척수 수술 중 가장 많이 사용되는 감시 도구로, 말초 신경 자극 전극에 의해 발생된 신호를 대뇌 피질에서 기록하여 감각로 및 수술 중 신경계 변화를 감시할 수 있다[5,6]. 상지에서는 주로 정중신경(median nerve)에서 전기자극을 주고, 팔신경얼기(brachial plexus), 척수뒤기둥(dorsal column), 쐐기다발(fasciculus cuneatus), 안쪽섬유띠(medial lemniscus)를 거쳐 반대측 상지 감각피질(sensory cortex)에서 기록한다. 하지에서는 주로 뒤정강신경(posterior tibial nerve)에서 자극을 주고, 허리엉치신경얼기(lumbosacral plexus), 척추뒤기둥, 널판다발(fasciculus gracilis), 안쪽섬유띠를 경유하여, 반대측 하지 감각피질에서 신호를 기록하게 된다. 따라서 SSEP는 척수뒤기둥을 감시하는 데에 매우 유용하게 사용될 수 있다. 그 외에도, SSEP는 검사를 하여도 환자의 움직임이 없어서 수술에 지장을 주지 않으므로 수술 중 지속적으로 시행할 수 있으며, 신경근육차단제의 영향을 적게 받는다는 장점이 있다. 널리 사용되고 있는 경고기준(alarm criteria)은 기준파형 대비 수술 중 진폭의 50% 이상 감소, 또는 잠복기의 10% 이상 연장이 사용되고 있다[7]. 이러한 기준을 사용할 때, 최근 척수내종양(intramedullary spinal cord tumor) 수술 중 시행한 IONM 메타분석에서 SSEP는 민감도 80.8%, 특이도 71.4%를 나타냈다[8]. 또한, SSEP는 운동신경기능의 손상을 판단하는 데에는 MEP보다 열등한 것으로 알려져 있다[9]. 따라서 위음성과 위양성을 고려할 때, 척수수술에서 SSEP 단독으로 감시하기 보다는 다른 도구를 함께 사용하는 것이 권장되며, 수술 전체의 흐름과 전신상태 및 사용약제를 고려하여 판단해야 한다.
MEP는 자극방법에 따라 두개경유전기자극(transcranial electrical stimulation, TCE stimulation, TES)과 직접뇌피질 자극(direct cortical stimulation, DCS)이 있으며, 척수수술에서는 TCE 자극을 사용한다. 기록하는 위치에 따라서 근육 MEP(muscle MEP, mMEP), 신경 MEP(neurogenic MEP), D-파형(D-wave) 등이 있다. 가장 보편적으로 사용되는 방법은 TCE-mMEP가 척추수술에서 주로 사용되며, 특히 척수수술에서는 D-wave를 같이 감시하는 것이 추천된다[2]. 일반적으로 척수에서 MEP는 피질척수로를 주로 감시하기 때문에, 척수뒤기둥을 주로 감시하는 SSEP보다 수술 후 운동기능 장애를 예측하는 데에 더 효과적인 것으로 알려져 있다[9]. 2000년 이후의 척수내 종양 수술 연구를 대상으로 시행한 메타분석에서 TCE-mMEP 및 D-wave를 이용한 MEP 감시 결과, 민감도 83.8%, 특이도 82.9%로 SSEP보다 우월한 결과를 보였다[8].
척수수술에서 피질척수로(corticospinal tract)를 감시하는 방법으로, 비특이적으로 운동신경섬유를 자극하고, 수술 부위에 따라 상지와 하지의 적절한 근육에서 기록을 하게 된다. 두개경유전기자극은 Cz, C1과 C2, 또는 C3와 C4에 전극을 위치하고 3–7개의 복수펄스 자극(trained multiple pulse stimulation)을 주며, 이러한 전기자극은 심부뇌조직(deep brain structure)의 운동신경섬유를 자극한다[10]. 수술 부위보다 원위부에서 최소한 두 개 이상의 근육에서 mMEP를 감시해야 하며, 수술 부위보다 근위부의 한 개 이상의 근육에서 mMEP를 기록하여 대조군으로 사용한다. 기록하는 근육의 수가 많을수록 민감도 및 특이도를 높일 수 있고, 장기적인 예후를 추정하는 데에 도움이 된다[11]. 일반적으로 상지의 경우에는 어깨세모근(deltoid), 위팔두갈래근(biceps brachii), 엄지두덩(thenar) 근육 중 짧은엄지벌림근(abductor pollicis brevis, APB)에서 기록하고, 하지의 경우 가쪽넓은근(vastus lateralis), 앞정강근(tibialis anterior, TA), 엄지벌림근(abductor hallucis, AH)에서 기록하며, 항문조임근(external anal sphincter, EAS)에서도 기록할 수 있다.
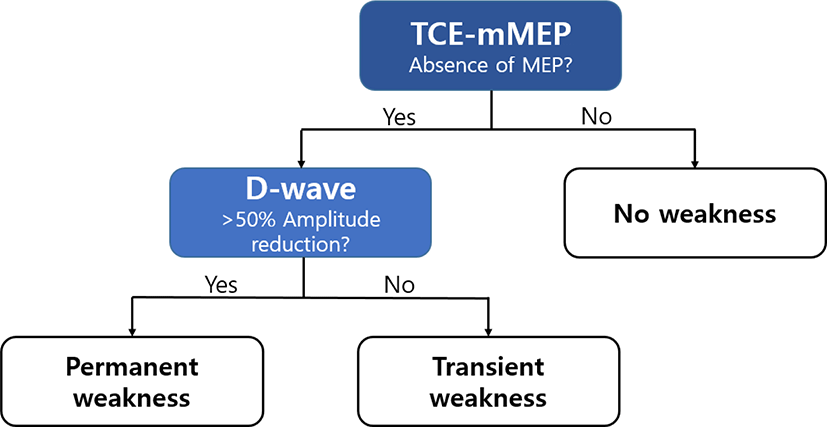
척수수술에서 TCE-mMEP의 경고기준은 파형의 완전 소실(absence of MEP)이 가장 특이적(specific)인 지표로 알려져 있어 “all or none” 방식을 가장 많이 사용한다. 하지만 파형의 완전 소실이 아닌 MEP 파형 크기(amplitude)의 감소가 있는 경우에도 수술 후 경미한 마비가 발생하는 경우가 있으므로 유의해야 한다[12].
AH와 같이 많은 숫자의 피질척수로 운동신경섬유(corticospinal motor fiber)에 의해 조절되는 근육에서 기록한 mMEP는 특이도가 높고, TA와 같이 적은 숫자의 피질척수로 운동신경섬유에 의해 조절되는 근육에서 기록한 mMEP는 민감도가 높아서 결과 해석 시 이를 고려하여 위양성 및 위음성을 가려야 한다[13]. 그리고 항문조임근 전극을 사용하면 척수종양 수술을 비롯한 척수 및 척추수술에서 장-방광 이상(bowel-bladder disorder)의 발생을 감시할 수 있다[14].
TCE-mMEP는 낮은 빈도이지만 경련(seizure)을 유발할 수 있고, 너무 temporal에 가까운 lateral side를 자극할 경우 입천장근육이 수축하여 혀나 턱에 손상이 발생할 수 있다. 또한 자극을 시행할 때마다 파형의 변동(inter-trial variability)이 크고[15], 자극 시 환자가 움직일 수 있기 때문에 SSEP와 같은 지속적인 감시는 어렵다는 단점이 있다. 뿐만 아니라, TCE-mMEP는 마취제 및 신경근육차단제 사용, 혈압, 온도 등 환경의 영향을 많이 받기 때문에 되도록이면 완전정맥마취(total intravenous anesthesia, TIVA)를 이용하고, 기준파형 설정에 용이한 근이완 상태가 되었을 때 마취과에 요청하여 근이완제의 주입속도를 설정하여야 하며, 마취제의 주입속도가 일정해진 후에 기준파형(baseline)을 설정하여 파형의 일관된 진폭이 유지되도록 하여야 하며, 대조군으로 사용되는 근육의 파형과 비교를 통해 위양성을 감별해야 한다. 수술 전 근력 저하가 있는 경우(MRC grade III 이하)와 척수 MRI T2강조영상에서 신호증가가 있는 경우, 기준파형 형성이 되지 않을 수도 있으므로 이러한 경우 Train 수를 늘리거나, 자극 세기를 높이거나, Double train 방식으로 MEP 자극 방식을 조정하면 파형 형성이 되는 경우가 있다[16].
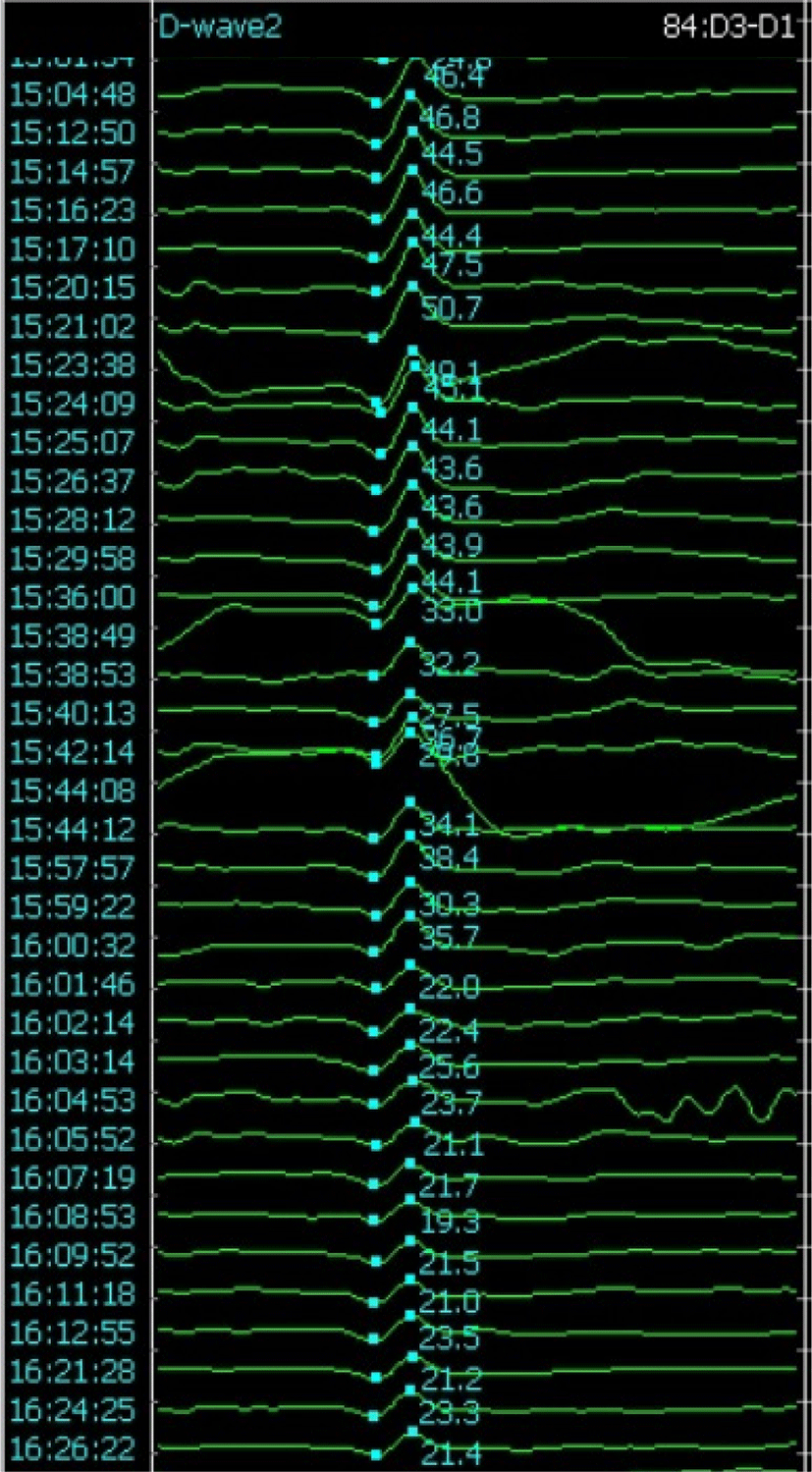
D-파형 역시 피질척수로를 감시하는 방법으로, 근육이 아닌 척수의 경막외(epidural) 전극에서 파형을 기록하는 도구이다. 특히 척수내종양 수술은 D-파형 감시가 가장 유용하게 쓰이는 분야이다[5]. 척수수술에서는 일반적으로 D-파형의 경고기준은 기준파형 대비 50% 이상의 진폭 감소를 사용하고 있다(Fig. 1)[11].
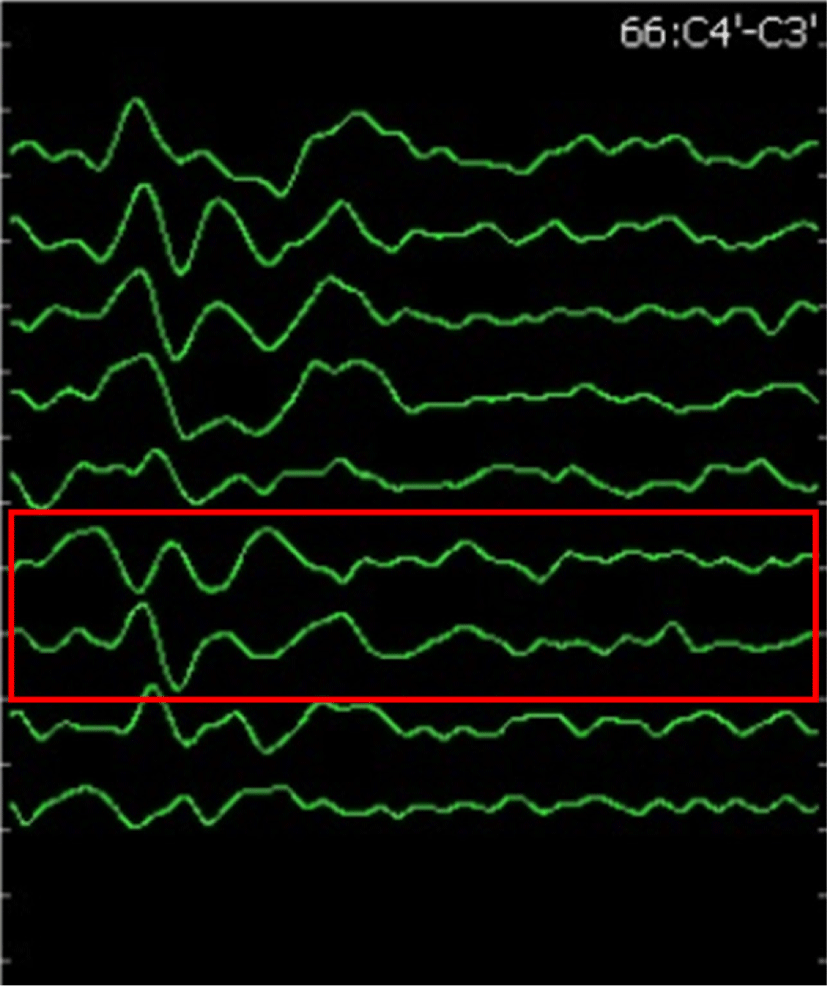
TCE-mMEP에서는 운동신경섬유를 자극한 신호가 시냅스(synapse)와 신경근육접합부(neuromuscular junction)를 건넌 뒤 기록이 되기 때문에 복수펄스 자극이 필요한 반면, D-파형에서의 자극신호는 시냅스를 지나지 않고 기록되기 때문에 단일펄스(single-pulse) 자극으로도 가능하다. 또한 작은 세기의 자극으로도 신호를 발생시킬 수 있기 때문에 환자의 움직임을 유발하지 않아 수술 중 지속적인 감시가 가능하고, 마취제나 신경근육차단제의 영향이 적다는 장점도 있다[17]. 특히, 척수내종양 수술에서 D-파형의 변화는 장기적인 신경계 장애를 예측할 수 있어서, TCE-mMEP의 이상이 있는 환자에서 D-파형이 변화가 없다면 단기간의 일시적 신경계 결손은 발생할 수 있으나, 장기적으로 좋은 예후를 기대해볼 수 있겠다(Fig. 2)[18,19].
하지만 D-파형은 몇 가지 제한점도 가지고 있다. mMEP 기록 전극은 근육에서 비교적 쉽게 측정할 수 있는 반면, D-파형은 수술자가 직접 척수 근처 경막외 공간에 기록 전극을 삽입해야 하는 위험이 있다. 또한 척수 근처에서 직접 신호를 기록해야 하기 때문에 T10 수준 하방에서는 전극을 위치시킬 수 없고, 좌우 구분이 없이 한꺼번에 신호를 받아 기록하기 때문에 한쪽 이상이 발생했을 때에 이를 발견하기 어려울 수 있다. 그리고, 척수의 피질척수로에서 축삭의 상태만 평가할 수 있고, 다른 구조물의 이상은 발견하기 어렵다[5,20].
자발근전도(free-running electromyography, frEMG)는 수술 중 신경뿌리를 감시하는 도구로, 척수 수술 부위와 연관된 신경뿌리가 지배하는 근육에 침전극을 설치한 뒤 자발적인 활동(spontaneous activity)을 기록한다[21]. 의미있는 frEMG 활동에는 극파(spike), 돌발파 전위신호(burst), 트레인(trains) 등의 파형이 있다. 척수내종양 수술에서 경고기준은 종양 수술 부위에서 불규칙적인 돌발파(irregular aperiodic burst)가 반복적으로 나타나거나, 3초 이상 지속되는 국소적 반규칙적인 긴장성 방전(focal semirhythmic tonic discharge), 또는 한 개 이상의 팔/다리에서 갑작스러운 신호의 저하로 정할 수 있고, 한 연구에서 민감도 87.5%, 특이도 83.3%로 그 유용성을 보고한 바 있다[22]. 긴장성 방전 외에도 위상성 방전(phasic discharge)도 나타날 수 있는데, 이는 일시적인 신경뿌리 자극에 의해서 나타날 수 있는 비동기화된 다상성 파형을 가리킨다. 이러한 frEMG는 주로 척추 수술 시에 각종 수술기구를 삽입하는 과정에서 더 유용하게 사용되지만, 신경뿌리에 연접한 척수수술의 경우에도 활용될 수 있다.
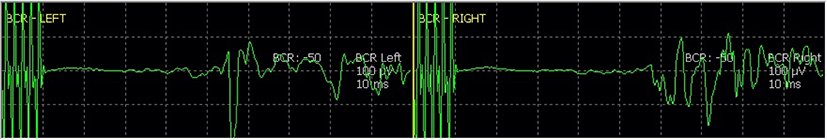
망울해면체근 반사(Bulbocavernous reflex, BCR)는 S2-S4 수준의 신경경로를 감시할 수 있는 도구이다(Fig. 3). 따라서 척수 수술에서는 척수원뿔(conus medullaris), 말총(cauda equina) 주변을 수술할 때에 활용할 수 있다. 자극 전극은 남성의 음경(penis) 또는 여성의 음핵(clitoris) 및 대음순(labia majora)에 위치시키고, 4–5회 펄스 자극을 준 뒤, 항문조임근(EAS)에 기록전극을 삽입하여 신호를 기록한다. BCR은 근이완상태의 영향을 매우 많이 받기 때문에, 특별한 수술적 문제가 없더라도 근이완 상태에 따라서 파형의 진폭 변화가 자주 발생할 수 있다. 따라서 BCR의 경고기준은 완전 소실을 기준으로 하고 있다. 한 연구에서 수술 중 BCR 완전 소실을 경고기준으로 하였을 때, 척수 및 척추수술에서 수술 후 6개월째 배뇨관련 기능을 예측하는 데에 특이도 88.5%로 유용한 감시가 가능하였다[23].
척수내종양 수술에서는 척수절개술이 대부분 필요하며, 이 과정에서 척수뒤기둥의 중앙선(midline)을 정확히 찾아내는 데에 척수뒤기둥 지도화(dorsal column mapping, DCM)가 활용된다. 정상적인 구조에서는 뒤정중고랑정맥(dorsal median sulcal vein)이 놓여지는 중간선솔기(midline raphe)나, 좌/우 신경뿌리 진입부(nerve root entry zone)의 한가운데로 육안으로 찾을 수 있으나, 종양에 따른 구조의 변형, 부종, 신생혈관의 생성 등으로 일반적인 해부학적 위치가 왜곡되는 경우 DCM이 중앙선을 찾는 데에 꼭 필요하다.
DCM 방법에는 몇 가지가 있으나, 널리 사용되는 기법은 SSEP를 활용한 ‘위상역전기법(Phase-reversal technique)’이다[24]. 여러 개의 접합부에서 자극이 가능한 소형 전극띠(electrod-strip)를 척수뒤기둥에 위치한 뒤 직접전기자극(direct electrical stimulation)을 주고, 두피 전극에서 이를 기록하여 위상역전이 나타나는 두 개의 접합부 사이를 중앙선으로 찾는 방법이다(Fig. 4). 이러한 DCM을 이용하면 척수절개 과정에서 빈번하게 발생할 수 있는 척수뒤기둥 이상 증후군(dorsal column dysfunction syndrome)의 발생을 감소시킬 수 있다[25].
수술 후 운동기능의 보전 여부가 중요하기 때문에 수술 중 척수 내에서 실시간으로 해부학적인 피질척수로의 위치를 찾으려는 노력이 지속되었다. 과거에는 경두개전기자극과 척수전기자극을 동시에 하였을 때, 척수전기자극 부위가 운동기능 영역이라면 경두개전기자극과 척수전기자극이 서로 충돌하여 경두개전기자극으로 발생하는 D-파형의 진폭의 감소가 관찰되는 것을 관찰하여 피질척수로를 찾는 방법이 고안되었다[26]. 그 후 척수내종양을 Ojemann 피질자극기(cortical stimulator)로 직접 자극하여 EMG 활동을 나타내지 않는 비정상적인 조직을 지도화하여 안전한 절제경계면을 확보한 방법도 있었다[27]. 근래에는 Kartush 동심형 양극탐색자(concentric bipolar probe)를 이용한 운동신경섬유 직접 자극과 개별 근육에서의 감시를 통해 고해상도 운동로 지도화가 가능해졌다[28]. 이를 통해 척수내 수술 시 더 안전성을 더욱 향상시킬 수 있게 되었다.
경수 수술에 있어서는 척수를 온전히 보전하거나 손상을 최소화 하는 것 외에도, 신경 뿌리를 모니터하는 것도 중요하다. 그리고 경추 수술에서 SSEP 변화는 특이도가 좋지 않기 때문에 MEP 등 다른 도구를 같이 모니터하는 것을 권고하고 있다[29]. 신경 뿌리를 모니터하는 방법으로는 자발 근전도가 가장 유용한 것으로 알려져 있고, 일부 연구에서는 근육분절에 맞는 자발 근전도 감시는 신경 뿌리 마비 발생을 유의하게 감소시켰다[30]. SSEP를 통한 감시에서는 주로 정중신경을 이용하는데, 이는 주로 C6 신경 뿌리를 경유하는 경로를 갖기 때문에, C6보다 원위부의 수술에서는 적절한 감시가 어려울 수 있다. 그러므로 경우에 따라서는 C8 신경 뿌리를 주로 경유하는 척골신경을 이용하는 SSEP를 감시하는 방법이 사용되기도 한다[31]. 뿐만 아니라, 특히 척수내종양 수술에서는 경수 및 흉수까지는 D-파형 감시가 가능하기 때문에 장기적 예후를 평가하고, 척수 기능을 모니터하기 위해 D-파형 감시가 권장되고 있다.
요천추부에서 척수강 내 수술이 필요한 경우, 신경 뿌리 부위의 보전에 주의해야 한다. 이러한 경우, 가장 유용한 장비는 SSEP와 자발 근전도이다. 자발근전도는 민감도가 높고, SSEP는 특이도가 높기 때문에 두 검사는 상호 보완적이며, MEP를 포함하여 모니터하는 경우 더욱 도움이 된다. 자발 근전도는 신경 손상에 대한 특이도가 낮기 때문에, 자발 근전도 이상이 나타날 경우 SSEP 및 MEP를 주의깊게 관찰하며, 수술을 진행하도록 해야 한다. 척수 결박 증후군(tethered cord syndrome) 수술에서는 천수(sacral cord)가 가장 취약할 수 있기 때문에, 배뇨, 배변 기능이 영향을 받을 수 있다. 천수 기능을 효과적으로 감시하기 위해서는 BCR 감시 및 외항문 괄약근 MEP 감시, 음부 신경(pudendal nerve) SSEP가 도움이 된다[32]. 그 외에도, 요천추부 신경근 지도화는 유발 근전도(triggered EMG)로 가능하여 수술 중 신경 구분에 도움이 된다.
척수 수술, 특히 척수 종양 수술에서 IONM의 가치는 여러 연구에서 증명되어 왔다. 다양한 경막내 척수 종양(intradural spinal tumor) 수술에서 SSEP 및 MEP를 이용한 IONM은 민감도 92%–95%, 특이도 97%–99%로 효과적으로 수술 후 신경계 합병증을 발견할 수 있었다[33,34]. 경막내척수외 종양(intradural extramedullary tumor) 절제술에서도 IONM은 민감도 75%–82%, 특이도 95%–100%로 신경계 손상을 예측할 수 있었다[35,36]. 척수내종양에서는 최근 메타분석에서 민감도 84%, 특이도 60%로 신경손상을 예측할 수 있었는데, 특이도가 높지 않아 위양성을 충분히 고려하여야 한다는 제한점도 보였다[8]. 그 외에도 척수내종양 수술에서 SSEP, MEP, D-파형 감시와 DCM을 통하여 신경손상을 예방할 수 있었고, IONM을 시행하면 수술 후 신경기능이 양호한 결과 보고도 있었다[37]. 특히 다양한 IONM 방법을 사용하는 것(multimodal IONM)이 더욱 효과적으로 수술의 예후를 호전시켰고, 이는 척수 및 척추 수술에서 Level 1 근거로 가장 먼저 권고되고 있다[4,33].
결론
IONM은 수술 중 신경계 손상을 조기에 발견하여 수술의 안전성을 향상시키고, 집도의로 하여금 안정적인 수술을 할 수 있도록 도우며, 환자로 하여금 수술 후 합병증을 최소화 하는 데에 그 목적이 있다. 척수수술에서도 IONM은 이와 같은 목적에 부합하여, 수술 중 필수적인 요소로 강력하게 권장되고 있다. 향후 척수 수술에서의 IONM은 그 정확도를 높여, 특히 종양 수술에서 충분한 종양절제가 안전하게 이루어지도록 연구되어야 하며, 각각의 수술 별로 수술 중 상황을 충분히 반영한 개별화된 IONM 판독이 되도록 할 필요가 있다. 발전된 첨단 기술로 다양한 분야의 도구를 활용하여 IONM에 접목시켜 새로운 장비와 기술을 개발하는 것 또한 IONM을 더욱 발전시킬 수 있을 것으로 생각된다.