서론
척수 수질내 종양(intramedullary tumor, IM tumor)은 전체 척수 종양의 5%–15%, 전체 중추신경계 종양의 약 3%–4%를 차지한다고 알려진 드문 질환으로[1,2] 일반적으로 수술적 절제가 첫 번째 치료가 되고, 일부 환자에서 방사선 치료가 더해지게 된다[3,4]. 종양의 위치상, 수술 도중 일부 신경 조직의 손상이 불가피한 경우가 있는데, 전절제술(gross-total resection)의 경우 수술 후 신경학적 악화가 발생하는 비율이 5%–30% 정도로 다양하게 보고되어 왔다[5,6]. 수술 후 신경학적 결손을 줄이기 위해, 수술중신경계감시(intraoperative neurophysiological monitoring, IONM)가 적극 도입되면서 척수 수질내 종양에서도 수술 후 신경학적 예후에 IONM의 적용이 긍정적인 효과를 미치는 것으로 여러 연구그룹에 의해 보고되어 왔다[7–10]. 거의 대부분의 척추 수술에 기본적으로 적용되는 운동유발전위(motor evoked potentials, MEPs), 체성감각 유발전위(somatosensory evoked potentials, SSEPs), 자유진행 근전도(free-running EMG) 및 병변의 위치를 고려해 일부 수술에서 추가적으로 시행되는 구해면체근반사(bulbocavernosus reflex, BCR) 감시 외에도[11,12], 척수 절개술(myelotomy) 및 수질내 종양 제거 과정에서 각각 뒤기둥(posterior column) 및 피질척수로(corticospinal tract)의 손상을 최소화하기 위한 척수 지도화(spinal cord mapping, SCM) 법도 국외에서는 활용되고 있다[13–15]. 본 종설에서는 국내에서는 아직 초기 단계이나, 추후 환자 상황에 따라 활용 범위가 넓어질 것으로 기대되는 대표적인 척수 지도화의 종류 및 방법, 임상적 적용 시 유의사항에 대해 다뤄보고자 한다.
본론
척수 수질내 종양에 접근하기 위해서는 기본적으로 척수를 절제해 들어가는 척수절개술 과정이 필요하게 된다. 이 경우, 해부학적으로 척수 뒤쪽의 좌우 뒤기둥 사이 중간을 찾아 시행하게 되는데, 육안으로 확인할 시 가장 많이 사용하게 되는 해부학적 기준점이 뒤정중고랑정맥(dorsal median sulcal vein)이 들어가는 중간선솔기(midline raphe) 부분 혹은, 양측 신경뿌리 진입부(entry zone)의 정가운데 지점이 되겠다. 하지만 이 경우, 수질내 종양 병변의 크기, 위치 및 성상에 따라 겉에서 보이는 해부학적 구조의 왜곡이 일어나 육안으로 구분이 힘들거나, 부적절한 척수절개술이 이뤄질 수 있다는 위험성이 존재한다. 실제로 척수 수질내 종양 제거술에서 수술 후 일명 ‘척수 뒤기둥 이상증후군(dorsal column dysfunction syndrome)’이 발생하는 환자의 비율이 30%–50%로 높게 보고되었다[16]. 뒤기둥은 기능적으로 말단의 진동감각 및 고유위치 감각 신호를 뇌쪽으로 전달하는 통로로 작용하므로, 해당 구조물이 손상될 경우 환자는 고유감각 소실, 보행장애, 이상 감각 등을 호소할 수 있다. 실제로 DCM이 수술 후 척수 뒤기둥 이상증후군의 발생을 줄이는 데 효과적인지에 대해서 2012년 한 연구그룹이 발표한 후향적 연구에 의하면[17], 총 91명의 척수 수질내 종양 환자를 DCM을 시행한 11명과, DCM을 시행하지 않은 80명의 환자로 나눠 수술 후 합병증 발생 여부를 비교했을 때, DCM을 시행한 그룹에서는 9%의 환자가, DCM을 시행하지 않은 그룹에서는 50%의 환자가 척수 뒤기둥 이상증후군 증상을 호소해, DCM이 수술 후 신경학적 합병증을 줄이는 데 효과적일 수 있다는 의견을 제시했었다.
DCM의 방법은 자극/기록 전극의 위치 및 자극 방법에 따라 크게 세 가지 방법으로 분류 가능하며(Table 1), 발표된 순서대로 살펴보면 아래와 같다.
| Quinones-Hinojosa’s method [18] | Yanni’s method [19] | Simon’s method [20] | |
|---|---|---|---|
| Direction | Antidromic | Orthodromic | Orthodromic |
| Stimulation location | Spinal cord | Peripheral nerve | Spinal cord |
| Recording location | Malleolus | Spinal cord | Cortex |
| Simulation intensity | 3 mA | 40 mA | 0.2 mA |
| Stimulation duration | 200 μs | 200 μs | 300 μs |
| Stimulation frequency | 9.1 Hz | 13.3 Hz | 3.17 Hz |
2002년도에 발표되었던 연구에서 사용했던 방법으로 척수를 자극하고, 양쪽 복사뼈(malleolus)에서 파형을 기록하는 방법이다[18]. 양극전극(bipolar electrode)을 이용해 척수 뒤기둥 쪽을 자극하고(intensity, 3 mA; duration, 200 μs; frequency, 9.1 Hz) 바늘 전극을 이용해 양측 내측 복사뼈에서 SSEP 파형을 기록했다. 우측 뒤기둥을 자극하면 우측 복사뼈에서 파형이 형성되고, 좌측 뒤기둥을 자극하면 좌측 복사뼈에서 파형이 형성되는 반면, 중간 지점(septum)을 자극하게 되면 양쪽 어디에서도 파형이 기록되지 않게 되어, 전기생리학적인 중앙선을 추정할 수 있게 된다.
2010년에 Yanni 그룹이 발표한 연구에서 사용한 방법으로 양측의 정강신경(tibial nerve)을 자극하고, 척수에서 파형을 기록한 방법이다[19]. 기록 전극을 총 8개의 다발전극(multielectrode)으로 이뤄진 격자(grid)를 이용했다는 점이 특이점이고, 이 기록 전극을 척수에 위치시킨 상태에서 양측의 정강 신경을 각각 자극한 다음(intensity, 40 mA; duration, 200 μs; frequency, 13.3 Hz; 100–200 sweeps), 파형을 얻었을 때 가장 큰 파형으로 기록된 격자 숫자들 사이의 중간 지점을 중앙지점으로 추정할 수 있다(예를 들어 좌측 정강신경 자극 시, 4번 격자에서 최대 파형이 기록되고, 우측 정강신경 자극 시 3번 격자에서 최대 파형이 기록된다면 3번과 4번 격자 사이의 중간지점을 전기생리학적 중앙선으로 추정하는 식이다).
마지막으로 소개할 방법은 2012년도에 처음 Simon 그룹에 의해 소개된 방법으로, 이후 현재까지 가장 널리 쓰이는 방법이라고 할 수 있다[20]. 해당 연구에서는 역시 8개의 접지점(contact)을 가지는 소형전극 스트립(mini-electrode strip)을 척수 수술 부위에 위치시킨 후 인접한 두개의 번호를 한 쪽 방향으로 옮겨가며 차례대로 자극하여(intensity, 0.2 mA; duration, 300 μs; frequency, 3.17 Hz), 피질에서(CP3- CP4 채널) 파형을 기록하였다. 그 경우 중간에 파형의 위상이 역전되는(phase reversal) 현상이 관찰되는데 그 사이 지점이 전기생리학적 중앙선에 해당한다고 볼 수 있겠다. 같은 저자들은 2년 후, 동일한 위상역전법을 더 많은 환자들에(n=12) 적용시킨 결과를 발표했는데, 육안적으로 median raphe를 구분할 수 없었던 5명의 환자 중 4명에서 위상역전법을 이용해 전기생리학적 중앙선을 찾아내, 신경학적 후유증 없이 척수절개술을 수행했음을 보여줬다[13]. 해당 후속 연구에서 위상역전법을 적용함에 있어 몇 가지 유의 사항 및 도움이 될 만한 점들을 언급했는데, 먼저 처음 이 방법을 소개할 당시 자극에 사용했던 소형전극 스트립 대신 검사자가 손으로 쥐고 직접 자극할 수 있는 양극전극기(bipolar stimulator, hand-held type)를 사용하였다. 이는 소형전극 스트립의 경우, 미세하게 박동하는 척수 표면에 위치시키면서 지속적으로 제대로 된 자극을 줄 수 있을 정도의 연결을 유지하기 위해서는 많은 시간과 노력이 소모된다는 점과 상대적으로 고비용이라는 단점이 있기 때문이었다. 두 번째로, 기록 채널에서 CP3-CP4 채널 외에 CPz-Fz 채널을 추가하는 것이 중요하다고 이야기했는데, 이는 자극 강도가 다소 강할 경우, 양쪽 뒤기둥이 동시에 자극되면서 나타나는 전류파급(current spread) 현상을 감별하기 위해서다. 전류파급 현상이 발생하면 극성(porlarity)의 상쇄에 의해 CP3-CP4/CP4-CP3 채널의 파형은 약해지면서, CPz-Fz 채널의 파형은 커지게 되는 반면, 적당한 자극 강도에 의해 전류파급이 없는 상태에서 전기생리학적 중앙선에 근접할 경우에는 두 채널 모두에서 파형이 약해지게 된다. 마지막으로 알아둬야 할 중요한 개념으로 언급된 것이 ‘negative mapping’인데, 뇌수술에서 negative cortical mapping 기술을 사용하는 것과 비슷한 개념이라고 할 수 있다[21]. 척수 표면의 특정 부분을 자극한 뒤, SSEP 파형이 형성되지 않음을 확인해 절개 부위를 결정하는 데 도움을 얻는 다는 것으로, 특히 제거대상인 종양이 연질막(pial surface) 바로 아래 위치하는 경우에, 전기생리학적으로 명확히 확인된 median raphe 부위보다 negative mapping을 통해 확인된 부분을 절개부위로 선택한 케이스들도 있음을 보여줬다.
DCM보다 아직 활발하게 이뤄지지는 않고 있으나, 현재 뇌수술 시 이뤄지는 피질/피질하 지도화(cortical/subcortical mapping)처럼, 향후 피질척수로의 손상이 수술 과정에서 직/간접적으로 예상이 되는 척수 수술의 경우에서는 활용도가 높아질 것으로 기대되는 영역이라고 할 수 있다. 특히 척수 수질내 종양의 경우는 종양 절제의 범위가 환자의 생존(survival)이나 재발율과 연관되어 있다고 알려져 있어[6], 최대한 많은 종양 조직을 절제하는 것이 필요한데, 이 경우 수술 후 신경학적 결손을 줄이기 위해 척수내 운동로 지도화가 유용하게 활용될 수 있겠다. 아직 보편화된 IONM 방법은 아니어서, 여기서는 실제로 적용한 사례에 대한 문헌 고찰을 하고, 더불어 척수 지도화에 있어 임상적으로 매우 중요한 이슈 중의 하나인, 사지근육에서 기록한 운동전위의 파형의 근원(generator)에 대해 간략히 언급하고자 한다.
최근에 나온 이중 트레인 자극을 이용한 지도화 이전에, 먼저 발표되었던 단일 트레인 자극을 활용한 지도화 사례를 먼저 살펴보도록 하겠다. 척수 조직은 상대적으로 뇌조직과 비교해 주요 신경로의 밀집도가 더 높은 구조물이므로, 고해상력 미세자극(high-resolution micro-stimulation)이 정확한 지도화에 중요할 것이다. 비교적 최근에 Gandhi 그룹에서 발표한 증례 보고를 보면[14], 경연수 연접부(cervicomedullary junction)에 위치한 척수 수질내 낭종성 병변을 제거하는 수술에서 기존의 MEP/SSEP 감시 외에 Kartush 자극기를 활용한 유발 근전도법을 추가해 운동로 지도화를 시행하였다. Kartush 자극기의 경우 양극 자극기로, 0.1–1.0 mA의 자극 강도, 1.0 ms 자극시간으로 자극을 주고, 각 하지 근육에서 바늘 전극으로 근전도 파형을 기록했다. 해당 수술에서 좌측 족부 근육에서 강한 파형이 형성된 종양 병변 경계부위의 경우, 다 제거하지 않고, 일부 남긴 채로 수술을 종료했고, 환자는 수술 후 발의 운동위약을 호소했으나, 추적 관찰 시 회복되었다. 이는 수술 후 신경학적 합병증을 최소화하면서 종양의 절제 범위는 최대한으로 설정하는 쪽으로 효율적으로 척수내 지도화를 활용한 사례라고 할 수 있다.
상기 사례에서 활용한 표준 형태의 전기 자극기(standard type probe)와 다르게 지속적으로 피질척수로를 실시간 감시하는 형태로 수술 도구를 활용한 연구도 소개된 바 있다[22]. 바로 CUSA(cavitron ultrasonic surgical aspirator)로 불리는 초음파 흡인기를 이용해 운동 신경로와의 근접정도를(proximity) 지속적으로 체크하는 방법인데, 이 방법은 뇌수술에서는 이미 피질하 지도화(subcortical mapping)를 시행할 때, 피질척수로의 위치를 감지하는 데 활용할 수 있다는 보고들이 다수 있었다[23]. 일부 연구자는 CUSA에 의한 근육반응을 화면으로 파형을 통해 감시하는 것뿐만 아니라, 집도의 입장에서 조금 더 용이하게 소리를 통해 감시하는(흡인기가 피질척수로에 근접할수록 소리가 달라지는 식) 방법을 시도하기도 하였다[24]. 홉인기를 이용한 방법은 표준 전기 자극기와 비교해, 감시하고자 하는 신경로의 흥분도를 지속적으로 체크할 수 있다는 점이 장점이다. 해당 연구에서 연구자들은 CUSA를 활용해 자극할 때, 3개의 펄스(interstimulus interval, 3 ms; intensity, 0.5–2.0 mA; duration, 200 μs)로 이뤄진 단일 트레인(train)을 활용했다[22]. 연구 초기에는 뇌수술에서 활용했던 자극지표(5-pulse; interstimulus interval, 3–4 ms; duration, 500 μs)를 적용했는데, 너무 과민한 반응을 보이고(육안으로도 피질척수로에서 확실히 거리가 있음에도 알람이 울림), ‘자극 관련 잡파(stimulus artifact)’가 상대적으로 길게 나와 근육반응이 가려지는 경우들이 있어, 일부 자극 지표를 수정했다고 한다. 이는 뇌에서의 피질척수로와 실제 기록 근육과의 거리보다 척수종양 수술보다는 상대적으로 가깝기 때문일 것이다. 물론 이런 초음파 흡인기를 활용함에 있어 아직 개선하고 연구되어야 할 점은 많이 있다고 할 수 있다. 먼저 종양의 최대한 안전한 절제라는 목표를 만족할 수 있는 적절한 민감도를 가지는 자극지표의 설정이 우선 필요하겠다. 뇌수술에서의 피질하 지도화의 경우, 다수의 연구를 통해 근육파형 형성을 가능케 하는 자극 강도의 역치(threshold)와 실제 해당 자극부위에서 피질척수로까지의 거리(근접도)간의 상관관계에 대한 정량적 분석이 이뤄진 상태지만[25], 척수 수술에서는 그런 자료가 아직은 없는 상태이다. 또한 CUSA 지도화는 기존의 전통적인 IONM과 동시 자극은 힘들기 때문에, 보통은 번갈아 가면서 사용하게 되는데, 과연 어떤 감시방법의 결과를 수술 중 신경계의 손상 여부를 반영함에 있어서 더 상위 단계의 판단 근거로 삼을지도, 후속 연구들을 통해서 밝혀져야 할 필요가 있다.
최근에 발표된 기법으로, 이 기법이 등장하게 된 배경을 간략히 설명하자면 아래와 같다. 척수 운동로 지도화에 있어, 피질척수로 외에 말초근육에서의 근전도파형을 형성 가능케 하는(위양성) 기타 신경로의 자극을 피하고, 두 경우를 감별하는 것이 지도화의 신뢰성을 높이는 데 매우 중요할 것이다. 위양성의 경우, 그로 인해 수술적 제거의 범위가 줄어드는 악영향이 있을 수 있기 때문이다. 오래 전부터 척수 자극 후, 기록되는 파형이 운동신경로가 아닌 감각신경로에서 기원하는 신호 가능성이 높다고 주장하는 연구결과들도 있었고[26–29], 실제로 앞서 언급했던 척수지도화 사례 보고에[14] 대해 피질척수로가 제대로 자극되었는지에 대해 의문을 제기하는 연구그룹도 있었다[30]. 대표적으로 뒤기둥을 자극하는 경우에도 사지근육에서 파형은 기록 가능하다고 알려져 있어, ‘피질척수로 자극’과 ‘뒤기둥 자극’ 사이의 감별이 매우 중요한 포인트가 될 수 있겠다.
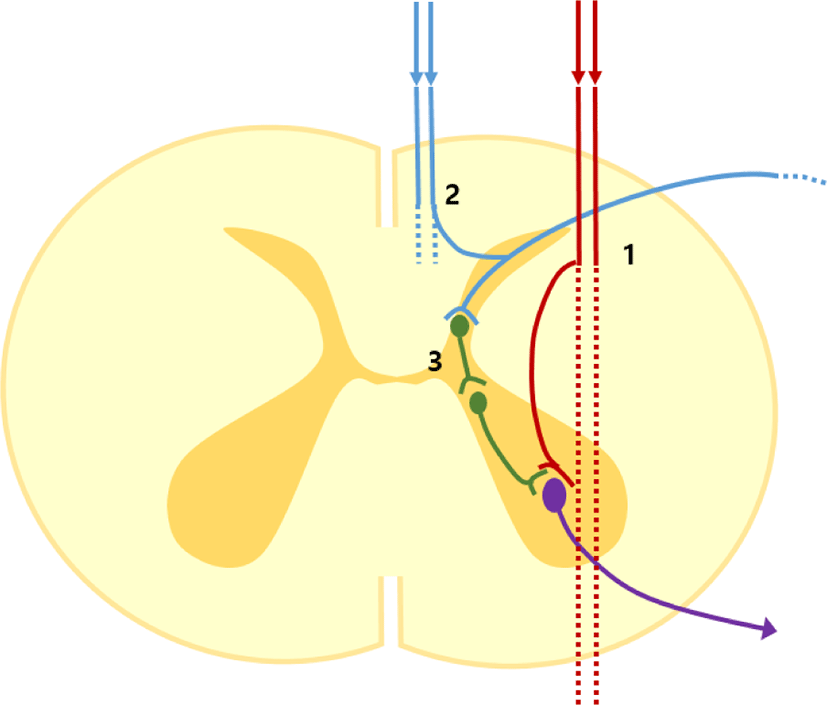
이와 관련해 2018년 Deletis 그룹에 의해 발표된 연구를 살펴보면 총 32명의 척수종양제거 수술을 받는 환자들을 대상으로 진행한 연구로, 양극 자극기로 각각 겉질척수로와 뒤기둥을 자극하면서(intensity, 0.3–5.0 mA; duration, 500 μs; interstimulus interval, 2–4 ms; 3–5 pulse) 사지 근육에서의 파형을 비교 분석하였다[15]. 연구를 두 단계로 나눠서 진행하였는데, 첫 번째로 위에서 언급했던 방법으로 ‘단일 트레인(single train)’ 자극을 주고 파형을 기록했을 때, 피질척수로 자극의 경우 94%의 환자에서 파형이 형성되었고, 뒤기둥 자극의 경우는 80%의 환자에서 파형이 형성됨을 확인하였다. 상당히 높은 비율로 뒤기둥 자극시에도 사지 근육에서 운동전위 파형을 얻을 수 있었는데, 이 경우 피질척수로 자극 유도 파형과 비교해 일관된 차이점은 잠복기가 더 길었다는 것이다(상지 근육; 약 3–5 ms, 하지 근육; 약 3–9 ms). 두 번째로는 동일한 자극 관련 수치를 사용하되, 단일 트레인이 아닌 ‘이중 트레인(double train)’ 자극을 주었는데, 피질척수로의 경우는 두 번째 자극에도 첫 번째 자극과 동일한 모양의 파형이 형성된 반면, 뒤기둥 자극의 경우는 두 번째 자극시에는 파형이 형성되지 않았다. 하지만, 환자가 임상적으로 경직(spasticity)이 심했던 경우는, 뒤기둥의 두 번째 자극 시, 파형이 형성되었는데, 첫 번째 자극과는 확연히 다른 모양의 파형이 기록되었다. 결국 이 연구 결과를 바탕으로 할 경우, 실제 수술장에서 척수 운동로 지도화시에, 직접 자극하게 되는 척수신경로가 피질척수로인지 모호할 경우, 이 방법을 이용해(이중 트레인 자극), 동일한 형태의 파형이 기록되는지 여부를 확인하는 것이 큰 도움이 될 수 있겠다. 저자들은 해당 연구 결과의 기전을 설명할 때 ‘centrally activated H-reflex’라는 용어를 사용하였는데(Fig. 1), 피질척수로 자극은 직접적으로 운동신경세포(알파-운동신경세포, alpha-motor neuron)를 활성화시키는 반면, 뒤기둥 자극은 척수 회색질의 사이 신경세포(interneuron)를 거치게 되는 다연접(polysynaptic) 회로를 통과해 운동신경세포를 흥분시키게 된다는 이론이다. 더 자세히 살펴보면, 뒤기둥 자극은 역방향으로 감각신경절(dorsal root ganglion, DRG) 세포를 흥분시키고, 흥분된 DRG가 방출하는 전위가 척수 회색질쪽으로 들어와 사이신경세포 연접을 거쳐 운동신경세포를 자극하게 된다. 그러다 보니, 피질척수로 직접 자극보다 긴 잠복기와 함께 불응기(refractory period)도 길어질 수밖에 없게 될 것이다. 이 점 때문에, 해당 연구에서 이중 트레인 자극 시에 트레인 사이 간격을 60 ms로 설정한 것인데, 이는 뒤기둥 구조물의 역방향 흥분에 의한 근육 반응의 경우는 회복기가 약 70 ms이고, 완전한 회복에는 대략 150–300 ms가 소요되는 반면, 피질척수로의 경우는 회복기가 60 ms 정도로 짧다고 밝힌 선행연구를 반영한 것이었다[31]. 환자가 임상적으로 경직이 있는 경우, 뒤기둥의 두번째 자극 시 첫 번째 자극과는 다른 모양의 파형이 형성되었던 점과 관련해서는, 경직이 발생하는 병태생리에 사이신경세포의 활성도 증가가 관여하기 때문에, 경직 환자에서는 첫 번째 전기 자극에 의해 올라간 사이신경세포의 흥분도가 여전히 유지되면서 두 번째 자극시에도 파형이 기록될 수 있을 것으로 여겨진다.
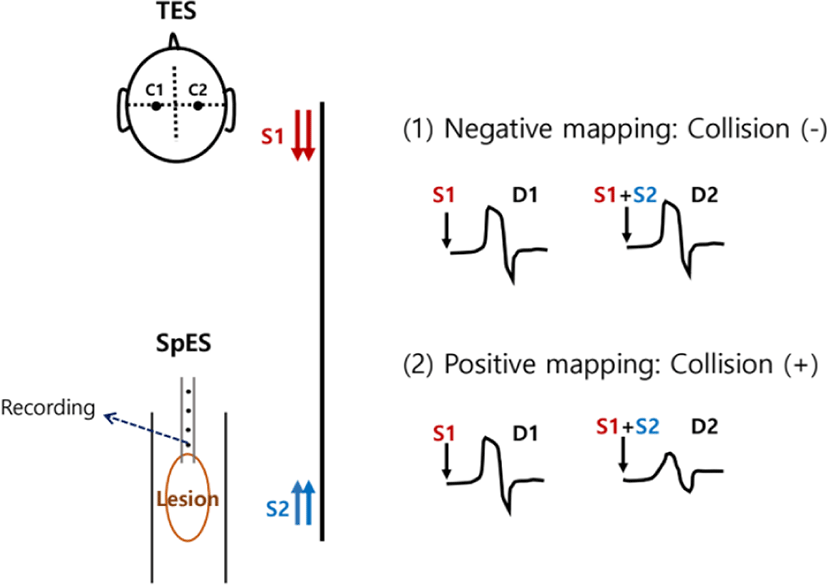
D-파형 감시는 국내 의료 현장에서는 여러 여건 상, 아직 활용되지는 못하는 감시법이지만, 국외에서는 다양한 종류의 척수 수술에서 수술중신경계감시의 중요한 구성으로 널리 이용되고 있다[32]. D-파형은 1954년 원숭이에서 운동 피질에 전기 자극을 가했을 때, 직접적으로 피질척수로의 ‘빠른 전도속도를 가지는 축삭(fast conducting axon)’들을 활성화시킬 수 있다는 것이 밝혀진 이래[33] 등장한 개념으로 척수 수술에서 경두개 전기자극 후, 척수 경막외 공간에서 척수 표면에 기록전극을 직접 위치시키고, 병변 기준 머리쪽(rostral) 및 꼬리쪽(caudal)에서 파형을 기록하게 된다. 시냅스를 거치지 않은 파형이기 때문에, 일반적으로 마취제 등에 영향을 받지 않고, 전체 피질척수로 신경섬유 대비, 작은 비율을 반영하는 파형이긴 하나, 피질척수로의 기능을 가장 잘 반영할 수 있다고 알려져 있다[34]. D-파형이 피질척수로를 구성하는 축삭 섬유의 흥분을 직접 반영하는 파형이라는 것을 이용해, 척수에서 운동로 지도화시 ‘D-파형 충돌 기법’이라는 방법을 이용하는 연구가 발표되었다[35]. 흉추에 위치한 척수 수질내 종양 환자 18명을 대상으로 시행한 해당 연구에서 저자들은 경두개 전기 자극을 줘서 척수 종양 병변의 위와 아래에서 D-파형을 기록함과 동시에, 노출된 척수 표면을 직접 동시에 자극하였다(양극 자극기를 이용하여 종양의 꼬리쪽에서 자극함; intensity, 2.5 mA; duration, 500 μs; frequency, 1 Hz). 이때 만약 척수 쪽에서 직접 자극한 신경섬유가 피질척수로라면, 위에서 아래로 내려오는 D-파형과 서로 충돌하게 되고, 이 경우 종양 병변의 머리쪽에서 기록되는 D-파형의 진폭이 이전보다 작게 기록될 것이다(Fig. 2). D-파형 충돌기법은 위 섹션에서 언급되었던 척수 자극 후 사지의 근육별로 기록되는 근전도 파형을 감시하는 방법과는 다소 다른 맥락이지만, 척수 종양 수술 도중, 육안상의 특정 지점이 운동로인지를 확인하는 것이 필요할 때 분명 유용하게 사용될 수 있는 기법이기에, 향후 D-파형 감시가 국내에서 가능해지면, 활발히 적용될 것으로 기대되는 바이다.