서론
뇌신경 또는 척수신경근(spinal root)의 활성화가 자발적으로 나타나거나 유발되어 근육에 나타난 반응이 복합근육활동전위(compound muscle action potential, CMAP)으로 기록되는 것을 수술중신경계감시(intraoperative neuromonitoring, IONM)에서 근전도(electromyography)라 한다[1–4].
1872년 Luigi Galvani는 전기자극으로 개구리의 뒷다리가 수축하는 것을 확인한 이후 근육의 전기신호에 대한 많은 연구가 진행되었고, 이러한 근전도는 1890년 Étienne-Jules Marey에 의해 처음으로 기록되었다. 이후 1922년 Gasser와 Erlanger는 근육의 전기신호를 기록하는 Oscillloscope를 개발하였으며, 근전도는 1960년대 수술 중 안면신경을 감시하는 데 처음으로 활용되었다[5,6].
수술중 근전도 감시의 방법으로는 자발근전도와 유발근전도로 크게 나누어지는데, 자발근전도는 수동적으로 근육의 전기신호를 기록하여 뇌신경과 척수신경근의 자극여부를 발견하는 것이고, 유발근전도는 신경이나 Hardware를 직접적으로 자극하는 것이다[1,4,7].
이러한 근전도는 수술중신경계감시에서 신경의 기능적인 수준에 대한 확인과 더불어 수술로 인해 유발된 신경손상을 초기에 발견하는 데 도움을 주고 있어, 척추수술이나 뇌신경에 관련한 수술에서 체성감각유발전위(somatosensory evoked potential, SSEP), 운동유발전위(motor evoked potential, MEP)와 더불어 유용한 감시방법의 하나로 사용되고 있다.
본론
운동단위활동전위 즉 motor unit action potential (MUAP)는 근전도를 이해하는 데 중요하다. 각각의 근육섬유는 동일한 운동종말판에서 활성화하는 운동단위로 구성되는데, 각각의 축삭이 활동전위를 충분히 발화할 정도로 자극받으면 그에 해당하는 각각의 운동단위가 활성화되어 근육이 수축한다. 개별적인 근육섬유의 활동전위는 합쳐져서 기록될 수 있는데, 이 때의 파형이 MUAP이다.
따라서 수술 중 축삭에 수술로 인한 자극(surgical irritation)이 역치를 넘어설 정도로 충분해지면, 축삭이 탈분극되며, 근육섬유들이 활성화된다. 이 때 하나의 축삭이 탈분극되며 나타나는 하나의 MUAP를, 수술중신경계감시의 근전도에서 “Spike”라고 한다[1,3,7–9].
수술로 인한 자극은 다양하게 운동단위를 유발할 수 있는데, 신경의 수술 전 기저 상태, 신경의 자극(neural irritation)의 정도나 기전 및 말초 신경-근 기능(neuromuscular function)에 따라 영향을 받는다[7].
그러므로 수술에 관여하는 특정 운동신경에 지배받는 근육들로부터 근전도를 통한 수술중신경계감시를 하는 것이 중요하다(Table 1).
근전도는 마취시 SSEP나 MEP와 마찬가지로 전정맥마취(total intravenous anesthesia, TIVA) 방법이 많이 사용되어지고 있으며, 신경근접합부에 작용하는 신경근차단제에 영향을 크게 받는다. 신경근차단제는 운동활성(motor activity)을 유의하게 감소시키기에 수술 중에는 피하는 것이 좋으나, 필요하다면 소량을 사용하고, 단회 정주가 아닌 지속적인 정주로 사용하는 것이 좋다[10]. 수술 중 근이완의 정도를 확인하기 위해 널리 사용되는 것은 Train-of-Four 방법이며, 대체로 2개 이상의 반응이 나타나거나, 두번째 반응에서 80% 이상 유발되도록 유지해야 한다[7,10].
자발근전도는 수술 중 뇌 및 척수 신경을 감시하는 수단으로 사용되는데, 관찰되는 근전도 신호는 신경이 긴장(stretch) 또는 압박되거나, 기타 기계적인 자극(mechanical irritation)에 의해서 나타나기도 하고, 열이나 냉기에의 노출, 나이 또는 수술 이전부터 있었던 신경손상 등에 따라 관찰되기도 한다[1,7,11]. 하지만, 허혈(ischemia)로 인해 신경손상이 나타난 경우에는 보통 활동전위가 나타나지 않아 근전도에서 발견되기 어렵다[1,7]. 따라서 수술과정에서 감시해야 할 특정 신경의 해당 근육들을, 적절하게 선택하는 것이 중요하다. 사전에 수술과정에 대해서 충분히 집도의와 협의를 하여야 하고, 해당 수술에 관련한 영상의학적 검사나 전기진단학적 검사 등을 숙지하여 감시해야 할 근육들을 선택하여야 한다(Table 1).
근전도 신호는 환자의 기저 상태를 포함해서 수술상황이나 수술환경과도 연관되어 나타나기에 임박한 신경손상 여부를 구분하기 위해 해석에 주의해야 한다. 근전도 신호의 양상은 발화(firing)의 빈도, 진폭 및 지속성에 비례하는 것으로 간주할 수 있어 임상적으로 중요하다[1].
수술 중 관찰되는 근전도 신호는 MUAP, 비정상 근전도 활성(abnormal EMG activity) 및 인공신호(artifactual signals) 등으로 나눌 수 있다[11,12]. 수술 중 확인되는 MUAP는 Semi-rhythmic 양상을 보이며, 근긴장도가 증가하거나 진정(sedation)이 불충분할 경우 관찰된다. 즉 수의적인 발화(voluntary firing) 후 이완이 충분하지 않거나 전각세포(anterior horn cell)의 반사활동(reflex activity)으로 나타난다[11,12].
수술 중 우연히 신경에 닿았을 때 하나 또는 몇 개의 운동단위가 무작위로 활성화하며 나타나는 것을 Spike라고 하며 이상(biphasic) 또는 삼상(triphasic)으로 하나의 큰 정점(≤ 2,000 μV) 양상을 보이고 임상적으로 중요하지 않다[7,9,13].
Spike와 달리 여러 운동단위가 활성화하며 나타나는 것으로 Burst라고 하며 기계적 접촉이 있을 때 나타나고 다상(polyphasic) 양상으로 5,000 μV 이상의 진폭을 보인다[1,2, 7,9,12](Fig. 1).
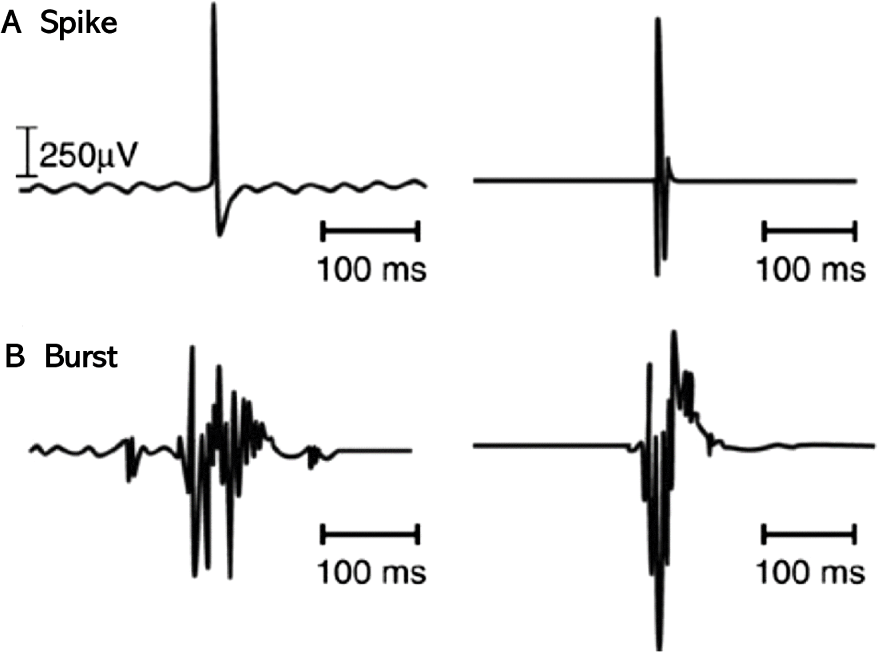
여러 운동단위가 지속적으로 활성화하는 것은 신경자극의 정도와 달라 임상적으로 중요하다[8]. Train은 반복적으로 수초에서 수분동안 여러 운동단위가 활성화하며 나타나는데 Burst와 달리 신경이나 신경근이 Stretching 되며 나타난다(Fig. 2). 이 중 A train는 갑작스럽게 나타나는 사인 모양 파동 양상(sinusoidal pattern)이며 고빈도(60–210 Hz), 짧은 지속기간(milliseconds–several seconds)이 특징이다. 이러한 A train는 10초 이상 지속되면 수술 후 신경학적 결손(neurologic deficit)을 의심할 수 있어 주의를 요하며, 복합연속방전(complex repetitive discharge)과 비슷하다[9,14–16].
그 외에 근전도 신호로 소작기(electrical cautery), 흡인관(suction tube)이 닿거나, SSEP를 위해 말초신경이 자극받을 때 흔하게 인공신호가 확인된다.
자발근전도를 사용하여 수술중신경계 감시를 할 때, 신호에 대한 해석이 어려워 위양성 또는 위음성 결과가 많다. 즉 신경이 예리하게 절단되는 등 심한 손상에서는 근전도신호가 나타나기보다는 어떠한 반응도 없는 electrical silence가 나타날 수 있다. 다시 말해 자발근전도감시는 민감도는 높으나 비교적 특이도가 낮고 경고 기준(warning criteria)이 명확하지 않은 단점이 있다[13,17–19].
하지만 자발근전도는 쉽고 실시간으로 수술중신경계감시를 할 수 있어 즉각적으로 집도의에게 feedback을 줄 수 있으며, 수술 상황과 맞추어 해석에 주의한다면 소뇌교각 수술에서 안면신경마비(facial palsy)나 경추수술에서 제5신경근마비(C5 palsy)의 예측에 유용하다는 장점이 있다[9,12,14,15,18–20].
따라서 자발근전도를 사용하는 수술중신경계감시를 하는 경우, MEP 및 SSEP를 함께 시행(multimodality IONM)하고, 환자의 기저 상태를 충분히 확인하며, 수술과정 및 수술환경과 연관하여 집도의와 마취의와 상의에 따라 근전도신호를 해석하는 것이 수술 후 신경학적 결손을 예방하는 데 도움이 된다.
수동적으로 근육의 전기신호를 기록하는 자발근전도와 달리, 유발근전도는 운동신경 주행 등 해부학적인 변이 등이 있을 수 있어 우선 신경이나 신경근을 확인하고, 신경과 신경근의 기능을 평가하며, 척추수술에서 나사못이 적절하게 삽입되었는지를 평가하는 데 주된 이유로 수술 중 사용된다[1].
유발근전도는 단극성(monopolar) 또는 양극성(bipolar) 자극탐색자(stimulation probe)를 사용하여 시행한다. 단극성 자극탐색자는 신경구조물의 일반적인 위치를 확인하는 데 비해, 양극성 자극탐색자는 전정신경으로부터 안면신경을 구별하는 것처럼 인접 구조물에서 신경의 정확한 위치를 식별하는 데 우월하다[1,2,4]. 일반적으로 단극성 자극탐색자는 척추경 나사못 자극(pedicle screw stimulation), 직접 신경근 자극(direct nerve root stimulation) 및 신경종에서 신경구조물을 구분하는 데 이용되어지는 반면, 양극성 자극탐색자는 뇌신경의 자극 및 신경이 아닌 구조물과 신경구조물을 구별하는 데 사용된다[1].
신경이나 신경근에 대한 직접적인 전기자극(direct electrical stimulation)은 해당 신경 및 신경근을 확인하는 데 도움을 줄 수 있다. 50–100 μs, 2.1 Hz의 square wave의 전기자극을 하면 신경이 탈분극되며 CMAP이 기록된다[12].
유발 근전도로 신경이나 신경근을 확인하는 방법으로는 해당 신경이나 신경근에서 0 mA부터 주의하며 자극세기를 올려 다른 신경이나 신경근에서 약하게 CMAP 나타날 때까지 진행한다. 뇌신경의 경우 자극강도를 0.01 mA로 간격으로 올리며 대체로 0.5–2 mA에서 CMAP이 확인된다[12].
전기자극의 궤적(locus)이 신경에 가까워질수록, 역치(threshold)가 낮아지며 신경 근처에서 자극이 덜 퍼지게 되어, CMAP의 잠시가 짧아지고 진폭이 커지게 나타난다[12]. 뇌신경의 경우 자극의 역치가 1 mA 이하라면 자극 주변에 신경이 근접한 것으로 집도의에게 고지하여 주의하며 수술을 진행할 수 있도록 해야 한다[12].
신경 및 신경근에 대한 직접적인 전기자극은 해당 신경 및 신경근의 기능적인 상태를 평가하는 데 사용될 수 있다. 정상 신경의 자극의 역치는 2 mA 미만이며, 손상 받았거나 만성적으로 압박되어진 병적인(pathologic) 신경이나 신경근에서는 활성화에 더 높은 전기자극의 역치가 필요하여 3 mA 이상이다[1,21]. 하지만 병적인 신경이나 신경근의 전기자극에 대한 역치가 더 높지만, 기계적인 자극(mechanical irritation)에 대한 역치는 더 낮아, 자발근전도에서는 Spike 또는 Burst 신호를 볼 수 있다[1].
수술 부위에서 직접 신경을 자극할 때 민감도와 특이도를 낮출 수 있는 위양성이나 위음성의 결과가 나타나는 경우를 고려해야 한다.
우선 위양성의 경우로 주변 조직을 통해 전류의 volume conduction 되는 것으로 청신경을 자극하였으나 안면신경에서 CMAP이 나타나는 것으로 current Jump라고 하며, 방지하기 위해 가능하면 양극성 자극탐색자를 이용하거나, 단극성 자극탐색자를 사용한디면 가능한 적은 자극으로 CMAP을 기록하도록 한다[2].
그리고 뇌척수액이나 혈액이 있게 되면 우회로가 생기면서 CMAP이 기록되지 않는 current shunting이 발생할 수 있어 위음성 결과가 보여진다. 이 경우 자극기는 절연되어 있어야 하고, 자극을 할 때에는 흡입기(suction tube)를 사용하여 예방하여야 한다[1,2].
척추경 나사못(pedicle screw)을 이용한 척추고정술(spinal fusion)은 척추의 변형을 교정하고, 안정성을 확보하기 위한 수술 방법으로 주로 흉요추 부위에서 많이 시행된다. 척추고정술시 척추경 나사못은 척추경을 통해 척추체의 피질골 속으로 삽입하여 위치하게 되는데, 척추경 나사못이 예정된 경로보다 안쪽이나 아래쪽으로 벗어나 위치하게 된 경우 척수신경근 손상의 가능성이 있다[1,22](Fig. 3). 척추경 나사못이 잘못된 위치로 삽입되는 경우는 2%–10%이며, 영구적인 척수신경근의 손상은 2%–3%에 이른다[22–26]. 따라서 수술중 영상유도(intraoperative imaging guidance)와 수술중 근전도감시를 함께 사용하여 정확하게 척추경 나사못을 위치시키는 추세이다[1,22].
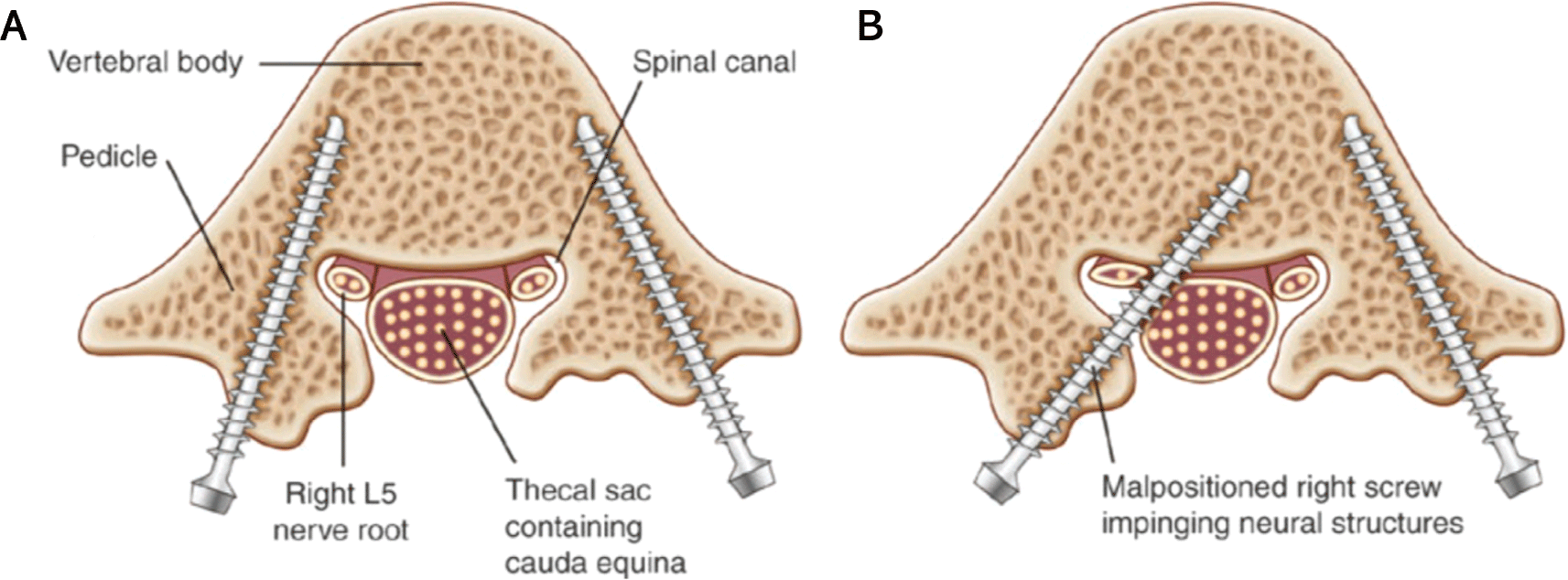
뼈(bone)는 절연되어 있어 전기자극시 척수신경근과 척추경 나사못 사이의 current transfer를 제한하는데, 척추경 벽(pedicle wall)에서 파손(breach)이 되면 나사못에서 척추신경근으로 낮은 저항의 전기도관이 발생하게 되고, 전기자극시 해당 척수신경근에 따라 CMAP이 기록될 수 있다. 따라서 전기자극시 10 mA 이상의 많은 전류가 신경근을 활성화하는 데 필요하다면 나사못이 척추경에 안정적으로 삽입되어 위치해 있다고 할 수 있으나, 5–7 mA 미만의 낮은 역치를 보인다면 나사못이 잘못 위치(screw malposition)의 가능성이 높다[1,7].
척추경 나사못에 대한 유발근전도 방법은 나사못을 직접 전기자극하거나, 나사못을 넣기 위해 만들어진 Hole을 통해 전기자극하는 방법이 있다[22]. 단극성 자극탐색자를 사용하여 100–300 μs, 2.0 Hz의 항전류(constant-current) 자극을 O mA로 시작해서 감시화면(screen)에 반응이 나타날 때까지 0.5–1 mA씩 자극을 올려가며 기록을 하며 집도의에게 고지해야 한다[1].
유발근전도를 사용한 척추경 나사못 검사는 여러 가지 요인이 영향을 주므로 10 mA의 역치는 절대적이지 않기에 해석에 주의해야 한다. 퇴행성 질환으로 오랫동안 압박되어 있던 척수신경근의 경우, 정상 척수신경근에 비해 더 높은 자극역치가 필요하다[21,27]. 실제로 같은 환자에서도 부위에 따라 신경 압박 정도가 다르며, 부위에 따라 척수신경근의 자극역치가 다양함을 알 수 있다[22]. 그리고 수술 부위 주변으로 액체 저류가 많을 경우 액체가 나사못과 접촉하게 되고, 액체는 낮은 저항을 형성하여 우회로(current shunting)로 작용하게 되어 높은 자극역치를 보인다[22,28]. 그 외에도 당뇨병성 또는 알코올성 다발신경병증, 골다공증 같은 환자의 신체 상태, 신경근차단제의 정도 및 척추경 나사못의 재질에 따라 전기자극에 따른 자극역치는 달라질 수 있다[27,29,30]. 따라서 여러 상황을 고려하여, 인접 부위나 반대측과 역치를 비교하면서 진행하는 것이 임상적으로 유용하다.
결론
근전도는 근육의 전기신호를 기록하는 것으로, 수술 중 근전도 감시의 방법은 뇌신경 또는 척수신경근의 자극(irritation)을 감지하는 자발근전도와, 신경이나 척추경 나사못 같은 hardware를 전기자극하여 기능을 평가하는 유발근전도로 이루어진다. 수술 중 근전도 감시는 신경손상을 빨리 발견할 수 있다는 유용한 장점이 있지만, 민감도에 비해 특이도가 낮은 제한이 있어 해석에 어려움이 있다. 따라서, 수술 중 근전도 감시의 역할 및 제한점을 충분히 이해하고, SSEP 및 MEP와 함께 수술중신경계감시를 하는 것이 수술 중 발생할 수 있는 신경손상의 가능성을 줄일 수 있다.
