서론
반쪽얼굴연축(hemifacial spasm, HFS)은 반쪽얼굴근육이 불수의적, 간헐적 그리고 불규칙적으로 수축하는 질환으로서, 보통 눈둘레근육(orbicularis oculi muscle)에서 시작되어 점차 반쪽얼굴의 모든 근육이 동시에 수축하게 되는 특징을 보인다[1–3]. 병리적으로, 이 질환은 뇌줄기로부터 얼굴신경(facial nerve)이 나오는 얼굴신경 기시부(root exit zone, REZ)를 주변의 뇌혈관이 압박하여, 얼굴신경 혹은 얼굴신경핵(facial nucleus)의 기능적 변성이 발생하여 생기는 것으로 알려져 있다. HFS의 치료는 얼굴신경을 압박하는 혈관을 분리시키는 미세혈관감압술(microvascular decompression, MVD)이 근본적인 치료법으로 알려져 있다[2]. HFS에 대한 MVD 시행시, 가장 심각한 합병증은 얼굴신경에 인접해 있는 전정와우신경(vestibulocochlear nerve) 손상으로 인한 수술 후 청력소실이다[4,5]. 전정와우신경 손상은 다음과 같은 여러 가지 이유로 발생할 수 있다. 소뇌뒤당김(cerebellar retraction) 중 전정와우신경의 당김, 신경-혈관 감압 중 혈관연축(vasospasm)으로 인한 허혈, 수술 중 기계적 혹은 열 손상, 삽입된 테플론 패드(Teflon pad)의 압박 등[6] MVD 중 수술후 청력소실 발생률은 과거 뇌줄기청각유발전위(brainstem auditory evoked potentials, BAEPs)를 이용한 수술중신경생리검사(intraoperative neurophysiological monitoring, IONM) 검사를 시행하지 않을 경우, 대략 7.7%에서 20%까지 보고되었다[3,7]. 하지만, BAEPs를 이용한 IONM 검사가 도입된 이후, 수술후 청력소실은 2% 이하로 크게 감소하였고, 현재는 BAEPs를 이용한 IONM은 HFS에 대한 MVD 시행시 필수적인 검사로 여겨지고 있다.
Fernandez-Conejero 등은 2012년에 HFS의 MVD 중에 활용되는 IONM의 전반적인 방법에 대한 종설을 발표했다[5]. 이후 최근 10년의 시간 동안, 이 분야에 있어서 많은 발전이 이루어졌고, 특히 IONM 중 BAEPs에 있어서 많은 진보가 이루어졌다. 본문은 최근 10년간 IONM 중 BAEPs에 관하여 발표된 논문을 중심으로 이에 대한 최신 지견을 정리하고자 한다.
우리가 일반적으로 신경생리검사에서 사용한 BAEPs는 한번의 자극으로 얻어진 하나의 BAEP 파형이 아니라, 여러 번의 자극으로 얻어진 복수의 BAEP 파형을 합쳐서 사용하는 것이다. 그렇기에, IONM에서 활용 가능한 BAEPs를 얻을 때, 조작이 가능한 주요한 변수가 2가지가 있는데, 하나는 자극빈도(stimulus rate)이고, 다른 하나는 평균화횟수(averaging trials)이다. 2006년 미국임상신경생리학회(American Clinical Neurophysiology Society, ACNS) 등은 10 Hz 이상의 빠른 자극은 BAEPs 파형의 진폭을 왜곡 혹은 감소시킬 우려가 있어서, 안정적인 파형을 얻기 위해서는 8–10 Hz의 낮은 자극빈도의 검사방법을 권장했다[8]. 또한 해석 가능하고 재현성 있는 BAEPs를 얻기 위해, 1,000–4,000회의 높은 평균화 횟수가 필요하다고 제시했다. ACNS가 제시한 이러한 권고를 따라, 10 Hz의 자극빈도와 1,000회의 평균화횟수를 적용한다면, 한번의 해석 가능한 BAEPs의 파형을 얻는 데 100초의 시간이 소요된다. 질병의 유무를 확인하기 위해 시행하는 외래 검사실의 검사라면, 비록 시간이 오래 걸려도 정확한 파형을 얻을 수 있다면 문제가 되지 않는다. 하지만, 수술 중 돌발적으로 발생하는 신경손상 유무를 빨리 확인하고, 이를 막아야 하는 IONM에서 BAEPs를 얻는 데 상대적으로 오랜 시간이 걸릴 경우, 이는 주요 신경의 손상 여부를 너무 늦게 확인하게 되어 영구적인 신경손상으로 이어질 가능성이 높아진다[9]. 하지만, 과거와 달리 IONM 장비의 발전으로 신호-잡음 비(signal to noise ratio)가 크게 개선되었고, 고빈도(high frequency) 자극을 사용할 때 주로 문제가 되었던 파형 왜곡이 감소하여, 고빈도 자극 검사가 가능해졌다. 실제로, 2016년 Joo 등은 40 Hz에서 100 Hz까지 고빈도 자극을 이용하여 BAEPs를 유발하였고, 당시 고빈도 자극 사용시에도 파형의 왜곡이 발생하지 않음을 보여 주었다[9]. 더 나아가 자극 빈도를 43.9 Hz의 고빈도로 고정한 상태에서, 평균화 횟수를 변화시키면서 추가 검사를 시행하였고, 400회의 평균화 횟수를 사용할 경우에도 1,000회 평균화 횟수와 차이 없이 안정적인 파형을 얻을 수 있음을 확인하였다. 이를 종합하여, Joo 등은 기존의 알려진 검사방법과 다른 43.9 Hz의 고빈도 자극빈도와 400회의 상대적으로 적은 평균화 횟수 적용한 새로운 검사 방법을 제안하였고, 이런 방식으로 적용하여 하나의 해석 가능한 BAEPs 얻는데 걸리는 시간을 10초 미만으로 단축시켰다(Table 1). 더 나아가, BAEPs 측정의 새로운 방식을 적용하였을 때, 이전 방식과 비교시에 수술후 청력소실을 크게 감소시킬 수 있음을 제시하였다(4.02% vs 0.39%, p = 0.002). 최근, 다른 많은 연구진들도 자극빈도 및 평균화 횟수에 변화를 주어, 30초 이내에 해석이 가능한 BAEPs를 얻는 방식을 적용하여 IONM에 활용하고 있다[10].
| American Clinical Neurophysiology Society [8] | Joo et al. [9] | |
|---|---|---|
| Stimulation frequency | 5–12 Hz | 43.9 Hz |
| Numbers of averaging trials | 500–1,000 | 400 |
| The time to obtain BAEPs | 100 s | 9.1 s |
BAEP를 취득하기 위한 표준 기록의 도출은 뇌파 검사용 10–20 전극 배치 시스템에 따라 Cz'를 기준으로 하여, 귓바퀴앞(preauricular) 또는 꼭지돌기(mastoid process) 전극을 사용한다[7,11]. 이런 기존의 방식을 사용시, 근접부위 전위(near-field potentials)에 해당하는 파형 I과 파형 II과, 원거리 부위 전위(far-field potentials)에 해당하는 파형 III부터 파형 V를 얻게 된다. 근접부위 전위와 달리, 원거리 부위 전위는 마취시에 진폭이 감소할 수 있다. IONM에서는 BAEPs를 활용할 때, 주로 파형 V를 활용하기 때문에, BAEPs의 원거리 부위 전위의 일관성과 진폭을 향상시키기 위해, Greve 등은 천막아래 접근법(infratentorial approach)으로 수술을 받은 30명의 환자(이 중 15명은 MVD를 받았다)를 대상으로 귓바퀴앞이나 꼭지돌기 대신에 Erb의 점(EP)에 기록전극을 배치하고, BAEPs 파형을 기록하였다[12]. 이렇게 기록 전극의 위치를 변경하였을 때, 파형 IV 및 파형 V의 진폭이 이전 검사방법과 비교하여 약 40%–50% 증가함으로 보여주었고, 이를 통해 수술 중 보다 크고 안정적인 BAEPs 파형을 얻을 수 있다고 제시하였다.
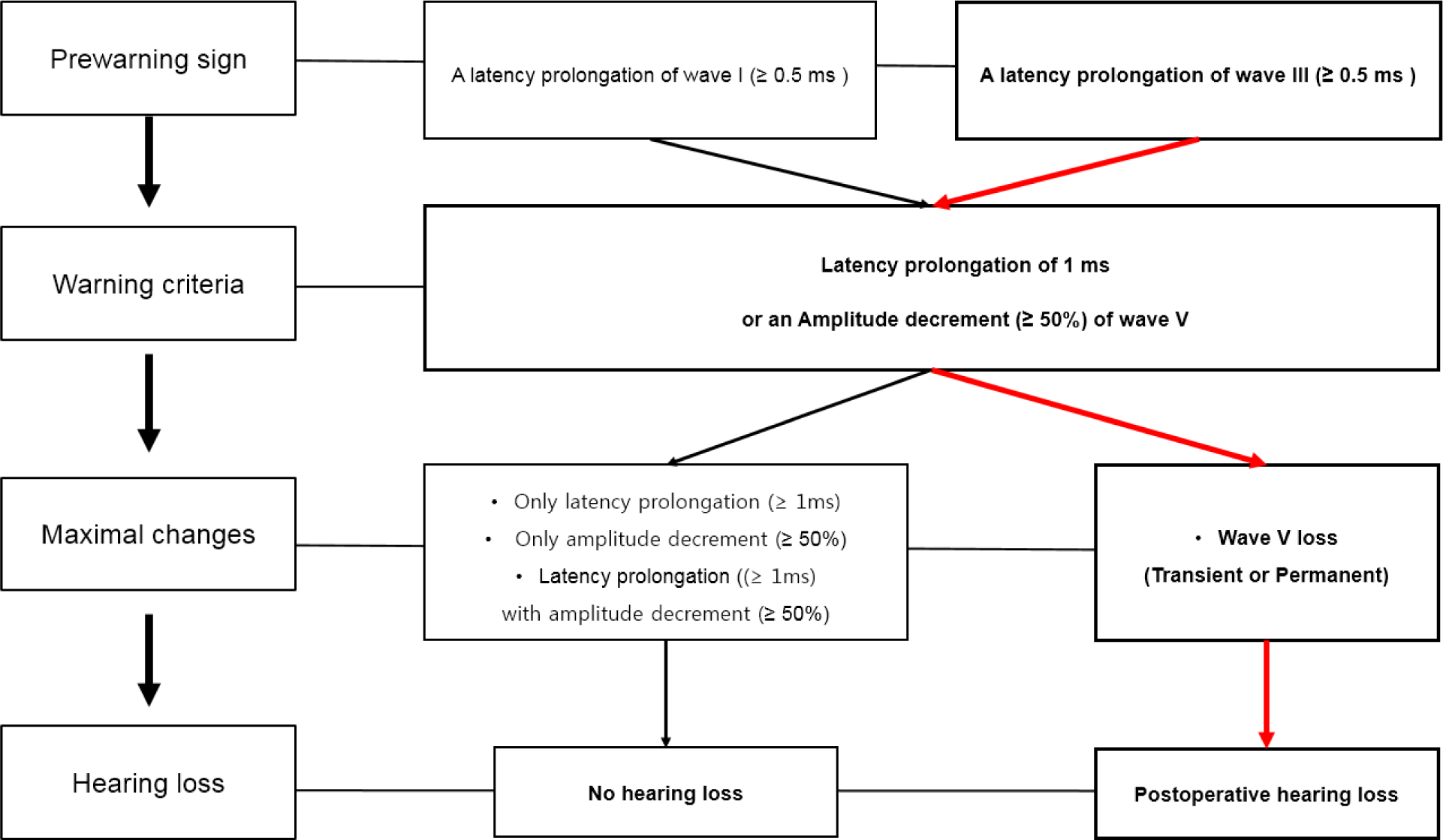
BAEPs의 IONM을 사용할 때, BAEPs의 여러 파형 중 경고 기준으로 주로 파형 V가 이용된다[4,5,7,13]. 이는 파형 V가 다른 파형에 비해 분명하고, 마취에 대해서도 상대적으로 영향을 덜 받기 때문이다. 이제는 MVD에서 BAEPs를 이용한 IONM이 필수검사로 자리를 잡았지만, 여전히 수술후 청력소실을 예측하는 BAEPs의 경고 기준에 대한 합의가 이루어지지 않았다. 과거, Polo 등은 파형 V의 잠복기가 0.6 ms 연장되는 것이 수술후 청력소실과 연관성이 높다고 제시하였다[4]. Grundy 등은 wave V의 잠복기가 1.5 ms 연장될 경우를 경고 기준으로 사용해야 한다고 제시했다[7]. 반대로, Hatayama와 Møller 등은 파형 V의 잠복기 연장은 항상 파형 V의 진폭 감소와 동반되고, 수술 후 청력 소실을 보였던 환자에서 파형 V 진폭 감소가 잠복기 연장보다 유의한 차이를 보였기에, 파형 V의 진폭 감소가 보다 유용한 경고 기준이라고 주장하였다[14]. 최근, Thirumala 등은 파형 V의 잠복기 연장 혹은 진폭의 감소보다는 파형 V가 일시적 혹은 영구적으로 소실된 경우가 수술 후 청력 소실과 직접적인 연관성이 있다고 보고하였다[10]. 그들은 파형 V의 잠복기 1 ms 연장 혹은 진폭의 50% 감소를 보인 환자 중 10.2%, 일시적인 파형 소실을 보인 환자는 25%, 그리고 영구적인 소실을 보인 환자들 중 60%가 청력 소실로 이어졌다고 보고하였다. 위와 같이 과거 유용한 경고 기준에 대한 많은 연구가 있음에도 불구하고, 이에 대한 공통된 기준이 부재했었다. 여전히 많은 연구자들은 경험적으로 2회 연속 BAEPs 상 파형 V의 잠복기 1 ms 연장 혹은 진폭 50% 감소를 경고 기준으로 사용하였다[4,5]. 하지만, 부정확한 경고 기준은 매우 심각한 문제이다. 경고 기준이 부정확할 경우, 이를 확인하고 교정하기 위해 불필요하게 수술시간이 지연되고, 더 나아가 불필요한 조작으로 수술 중 합병증으로 이어질 위험이 있기 때문이다. 이에 대해 Park 등은 수술 후 청력 소실과 연관된 경고 기준을 확립하기 위해, 932명의 반쪽얼굴연축 환자를 대상으로 시행된 MVD 중 기록된 BAEPs와 수술 후 청력 소실과의 연관성을 분석하였다(Table 2)[15]. 그들은 해석 가능한 하나의 BAEPs를 얻기 위해 43.9 Hz 자극 빈도와 400회의 평균화 횟수를 시행하여, 약 9.1초만에 BAEPs 파형을 얻는 방식을 적용하였고, 총 932명의 환자 중 11명(1.2%)의 환자에서 수술 후 청력 소실이 관찰되었다. 수술 중 BAEPs의 최대 변화를 기준으로 분석하였을 때, 파형 V의 영구적인 소실을 보인 환자가 11명이었는데, 이 중 6명(54.5%)이 수술 후 청력 소실을 보였고, 파형 V의 일시적인 소실을 보인 환자 27명 중 2명(7.4%), 그리고 파형 V의 잠복기 1 ms 연장 혹은 진폭 50% 감소를 보인 환자 96명 중 2명(2.0%)의 환자가 청력 소실로 이어졌다. 반면, 파형 V의 진폭 감소 없이 잠복기만 1 ms 이상 연장된 환자는 총 194명이었는데, 이 환자들은 수술 후 청력 소실로 이어지지 않았다. 심지어, 잠복기 연장만 보인 194명의 환자들 중 30명의 환자는 2 ms 이상의 잠복기 연장으로 보였으나, 이 환자들 또한 수술 후 청력 소실로 이어지지 않았다. 연구진들은 MVD 중 수술 후 청력 소실을 예측하기 위한 BAEPs 경계 기준의 타당성을 계산하였고, 파형 V의 영구적인 소실은 99.4%의 높은 특이도를 보였으며, 일시적인 소실은 96.7%, 진폭 50% 감소를 동반한 잠복기 1 ms 연장은 86.5%의 특이도를 보였다고 발표하였다. 이런 연구 결과를 바탕으로, 그들은 현재 통용되고 있는 파형 V의 잠복기 1 ms 이상 연장 혹은 진폭 50% 이상 감소의 경고 기준은 수술 후 청력 소실을 예방하는 데 부적절하다고 주장하였다. 그리고, 더 나아가 MVD 중 수술 후 청력 소실을 예방하기 위한 경고 기준에 대해 다음과 같은 ‘단계적 등급(sliding scale)’이 보다 적절하다고 제안하였다. 1) 관찰 징후(observation sign): 파형 V의 진폭 50% 감소 없이 잠복기만 1 ms 이상 연장; 2) 경고 징후(warning sign): 파형 V의 진폭 50% 이상 감소와 함께, 잠복기 1 ms 이상 연장; 3) 위험 징후(critical sign): 파형 V의 소실. MVD 수술 중 관찰 징후(observation sign)가 관찰될 경우, 검사자는 이를 집도의에게 바로 알리나, 집도의가 이에 반응하여 BAEPs 회복을 위한 조치를 취하기 않는다. 하지만 경고 징후(warning sign) 혹은 위험 징후(critical sign)가 관찰될 때에는, 검사자가 이를 바로 집도의에게 전달하고, 집도의는 이에 반응하여 진행 중인 수술을 중단하고, 이를 교정하기 위해 조치를 취하는 것을 제안하였다.
HFS의 MVD에서 경고 기준으로 파형 V의 진폭 50% 이상 감소 혹은 잠복기 1 ms 이상 연장이 사용되었지만, 최근 연구에서는 파형 V의 소실이 경고 기준으로 매우 중요함이 확인되었다. HFS의 MVD를 시행할 때, 파형 V가 소실이 발생할 경우, 두 가지 다른 패턴이 관찰된다: (1) 파형 I부터 모든 파형 소실 또는 (2) 파형 I은 유지된 상태에서 파형 V의 소실(Fig. 1). 파형 I은 달팽이 구역(cochlear area)에서 생성되기 때문에, MVD 중 달팽이 구역의 손상은 파형 I을 포함하여 모든 BAEPs의 완전한 소실로 이어질 수 있다. 특히, MVD 중 혈관 경련(vasospasm)으로 인해 달팽이 구역의 허혈성 손상이 발생할 경우 파형 I을 포함하여 모든 BAEPs의 완전한 소실이 발생한다[6,11]. 하지만, MVD 중 달팽이 구역은 손상이 되지 않은 상태에서 전정와우신경의 근위부가 손상될 경우, 파형 V는 소실되지만, 파형 I은 유지될 수 있다. Joo 등은 HFS의 환자들의 MVD 동안 파형 V 소실을 보인 36명의 환자의 자료를 분석하였다[16]. 이 중 12명(33.3%)의 환자가 파형 I을 포함하여 모든 BAEPs의 완전한 소실을 보였다는 것을 확인하였고, 이런 파형의 변화를 보인 환자들은 MVD 시행 후 청력 소실을 경험할 가능성이 높았으며(p = 0.009), 현기증이나 이명과 같은 청력 소실 외의 다른 합병증의 빈도가 유의하게 높다고 보고하였다. 또한, 이 연구에서는 파형 V 소실이 발생하는 시점을 분석하였고, 파형 V의 소실은 MVD의 주요 과정(소뇌뒤당김 혹은 테플론 패드의 삽입) 이후에도 빈번하게 발생할 수 있음을 보여주었다. 그래서, 저자들은 MVD 중 청력소실뿐 아니라 현기증, 이명 등의 심각한 합병증이 MVD의 주요 과정 이후에도 발생할 수 있음을 제시하며, HFS에 대한 MVD 수술시에 수술이 완전히 종료될 때까지 주의가 필요함을 강조하였다.
HFS의 MVD 수술에서 소뇌다리뇌각(cerebellopontine angle)에 접근하기 위한 소뇌뒤당김은 MVD 수술 중 전정와우신경의 주요 손상 원인으로 알려져 있다[6]. 소뇌뒤당김을 시행할때, 전정와우신경이 당겨지는 방향에 따라 BAEPs의 변화가 2가지로 나뉘게 된다.
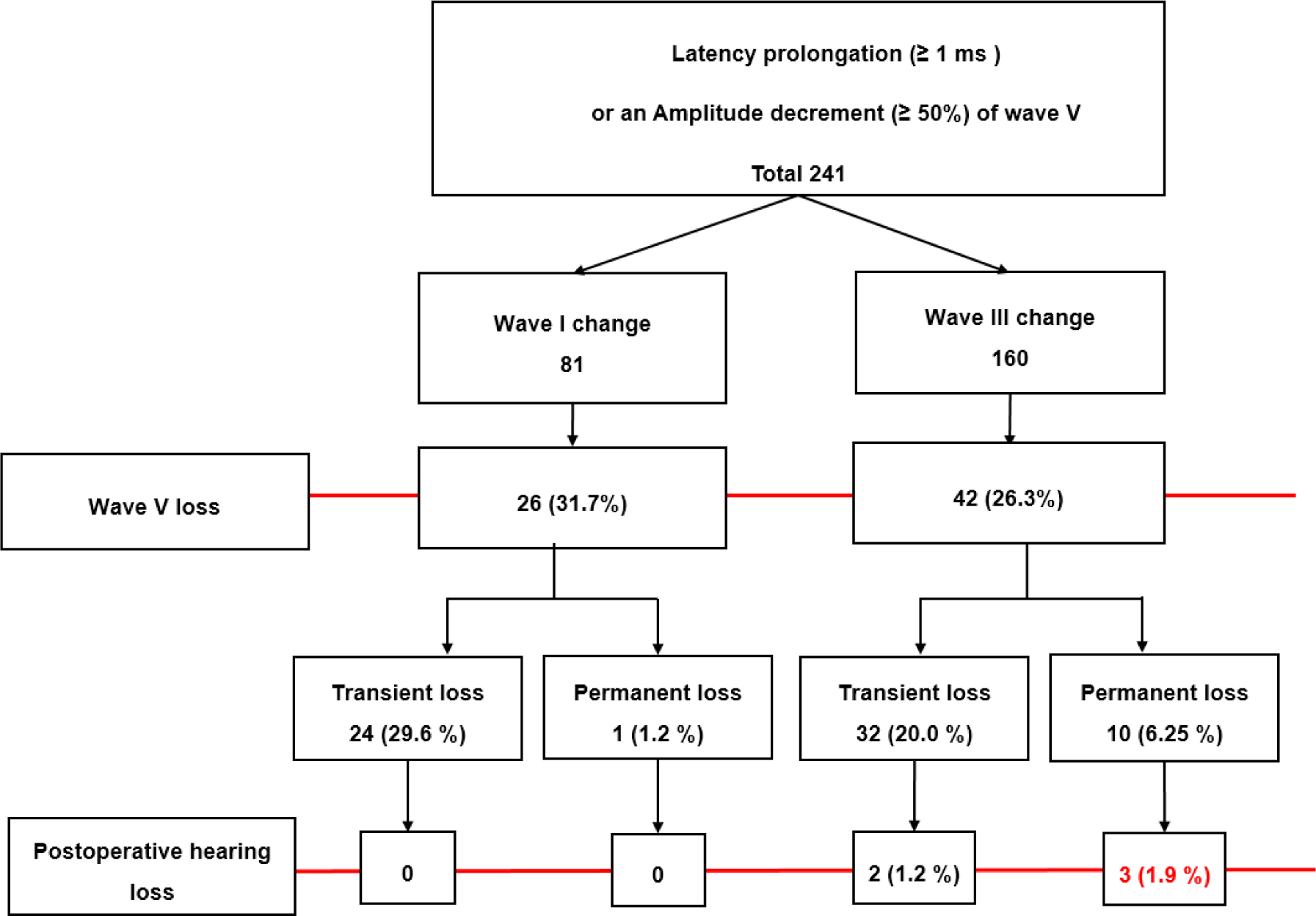
전정와우신경이 뇌줄기쪽으로 당겨질 때 발생 (2) 파형 III부터 연장: 전정와우신경이 뇌줄기에서 멀어지는 쪽을 당겨질 때 발생. Park 등은 MVD 중 소뇌뒤당김을 할 때, 파형 V의 경고기준의 발생 전의 변화를 조사하고, 그 의미를 분석하였다[17]. HFS에 대해 MVD를 시행한 환자를 대상으로 수술 중 BAEPs의 파형 V 진폭 50% 이상 감소 혹은 잠복기 1 ms 이상 연장을 보인 241명의 환자의 MVD 중 BAEPs 전체를 분석하였다. MVD에서 소뇌뒤당김을 시행하였을 때, 파형 V의 경고기준 변화 발생 전 일부 환자들은 파형 I부터 잠복기 0.5 ms 이상의 연장을 보였고, 나머지 환자들은 파형 I의 잠복기 변화 없이 파형 III의 잠복기가 0.5 ms 이상으로 연장되었다. 각각 그룹별로 빈도를 분석하였을 때, 소뇌뒤당김 시행시 파형 I의 잠복기 변화 없이 파형 III의 잠복기가 0.5 ms 이상으로 연장을 보인 환자가 전체 환자군의 2/3로 확인되었다. 이런 소뇌뒤당김시 경고기준 발생 전의 BAEPs 변화의 중요성을 확인하기 위해, 각각 그룹 간의 BAEPs의 가장 심각한 변화인 파형 V의 소실을 보인 환자들의 빈도 및 최종적으로 MVD 후 청력소실을 보인 환자들의 빈도를 분석하였을 때, 파형 V의 소실을 보인 11명의 환자 중 10명이 소뇌뒤당김 시행시 파형 I의 잠복기 변화 없이 먼저 파형 III의 잠복기가 0.5 ms 이상으로 연장을 보였고, MVD 후 청력소실을 보인 5명의 환자들도 소뇌뒤당김시 위와 같은 BAEPs의 변화를 보여주었다(Fig. 1). 저자들은 소뇌다리뇌각 주변의 REZ의 전정와우신경의 수초가 상대적으로 약하기에, 소뇌뒤당김시 심각한 손상으로 이어질 가능성이 높다고 분석하였고, MVD 중 소뇌뒤당김시 파형 V뿐 아니라, 파형 I과 파형 III의 잠복기를 면밀히 확인하는 것이 MVD 후 청력소실을 예방하는 데 필수적이라고 제시하였다(Fig. 2).