서론
척추경 나사못(pedicle screw, PS)을 이용한 척추고정술(spinal fusion)은 척추의 변형을 교정하고, 안정성을 확보하기 위한 수술 방법이다. 1940년대에 King [1]이 처음으로 척추에 나사못을 삽입하는 방법을 소개하였으며, 1962년에 Harrington [2]은 금속을 이용하여 측만증(scoliosis)을 교정하는 내고정술(internal fixation)을 시행하였다. 현재에 이르러 만성 퇴행성 척추 변형, 외상의 충격으로 인한 변형 및 척추 기형 수술에 이르기까지 척추경 나사못을 이용한 수술은 광범위하게 적용되고 있다[3,4].
그러나 척추경 나사못을 이용한 척추고정술을 시행할 때는 항상 신경 손상(neural insult)의 위험에 노출될 수밖에 없다. 이전의 연구에 의하면 척추고정술을 시행할 때 척추경 나사못이 잘못된 위치로 삽입될 확률은 2%-10%이며[5–7], 영구적인 척수신경근(spinal root) 손상은 2%-3%에 이른다[8]. 이러한 이유로 척추경 나사못 삽입 시 안정성 확보를 위해 여러 방법들이 활용되어 왔으며, 1992년 Calancie 등 [9,10]에 의해 유발 근전도(triggered electromyography, t-EMG) 검사를 이용한 새로운 실시간 감시 방법이 제안되었다. 이후 척추경 나사못 삽입 시 수술 중 신경계 감시(Intraoperative Neurophysiological Monitoring, INM)는 환자의 안정성 확보라는 점에서 높은 요구도로 이용되어지고 있으며, 이에 대한 연구도 활발하게 진행되고 있다.
본 종설에서는 척수신경근 자극 및 나사못을 이용한 척추고정술 시 적용할 수 있는 INM의 원리와 방법에 대해 구체적으로 알아보고, 척추경 나사못 삽입 시 적용되는 다른 검사 방법들과 비교하여 INM이 가지는 효용성 및 한계점에 대해서도 같이 다루고자 한다.
본론
나사못을 이용한 척추고정술은 경추, 흉추, 요천추에서 모두 시행되고 있으며, 주로 흉요추 부위에서 많이 시행되고 있다. 일반적으로 흉추와 요추에서는 척추경(vertebral pedicle)을 따라 척추체(vertebral body)로 나사못을 삽입하는 방식을 사용한다. 흉추에서는 주로 측만증이나 외상에 의한 척추 변형을 교정하는 수술이 주로 행해지고, 요천추에서는 척추관 협착증(spinal stenosis)이나 만성 신경근 병변이 동반된 퇴행성 척추 변형에 의한 수술이 주를 이룬다. 경추의 경우, 불안정성(instability) 동반되어 있을 때 고정술을 시행하며, 가쪽덩이(lateral mass)를 따라 나사못을 삽입한다.
척추경 나사못을 정확하게 삽입하기 위해서 수술자는 각 부위마다의 해부학적 특징을 이해하고, 위험을 최소화하는 방법으로 접근해야 한다. 척수신경근은 주로 척추경의 안쪽(medial), 아래쪽(inferior) 부위를 따라 주행하게 되며, 따라서 나사못이 척추경 내의 예정된 경로보다 안쪽, 아래쪽으로 벗어나 위치할 경우 척수신경근 손상의 가능성이 높다[11]. 경추에서도 가쪽덩이에서 지나치게 안쪽으로 나사못이 삽입될 경우 척수신경근 손상을 일으킬 수 있으며, 척추관(spinal canal)과 나사못의 거리가 최소 2 mm 이상 확보되어야 안정성을 보장할 수 있다는 연구 결과가 있다[12]. 뿐만 아니라 나사못의 끝은 척추체 내에 정확히 삽입이 되어야 하며, 너무 깊이 들어갈 경우 전종인대(anterior longitudinal ligament)나 혈관에 손상을 일으킬 수 있고, 나사못이 너무 얕게 삽입될 경우 삽입부가 헐거워지거나(loosening), 수술 부위로 원하는 만큼의 안정성이 확보되지 않을 수 있다.
흉추의 경우, 요추에 비해 척추경의 크기가 작으며, 이로 인해 나사못 삽입 시 척추경 골절 혹은 나사못 위치 이상(screw breach)을 보일 가능성이 상대적으로 높다. 또한 흉추는 상대적으로 척추관의 직경이 좁고, 주변에 흉막(Pleura), 큰 혈관(Great vessels), 식도(esophagus) 등 주요 장기 부분과 인접하고 있어 요천추에 비해 더 많은 주의를 요하며, 나사못 삽입의 위치가 잘못될 경우 심각한 합병증의 가능성을 내포하고 있다. 요천추의 경우, 척추경 및 척추관의 크기가 커서 수술자로 하여금 상대적으로 안전하고 쉽게 나사못을 삽입할 수 있게 해준다[13].
척추경 나사못 삽입 수술을 시행할 때 가장 먼저 해부학적 표식(landmark)을 따라 척추경 부위에 유도철사(guide wire)를 이용하여 나사못 삽입 경로(insertion tract)를 확보한다. 이때 전통적으로는 해부학적 구조에 의존한 촉감확인법(free hand technique)을 사용하여 삽입경로를 확보하는데, 수술 자는 척추경에 확보된 삽입 경로를 시각적으로 직접 확인하며, 촉진을 통하여 천공(perforation) 유무를 확인할 수 있다. 그러나 오늘날 대부분은 아래에서 설명할 수술 중 영상유도장치(intraoperative image guidance system)의 도움을 받아 시행하고 있으며, 촉감확인법 만으로 척추경 나사못 삽입술을 시행했을 경우, 영상학적 검사의 도움을 받은 것과 비교해 삽입의 정확도가 낮은 것으로 보고된다[14]. 또한 후궁절제술(laminectomy)이나 후궁성형술(laminoplasty) 등의 척추 후면 개방(open)을 동반하지 않는 경피 나사못 고정술(percutaneous screw fixation) 시에는 나사못 삽입 경로의 시진(visualization) 이나 촉진(palpation)법을 활용하기 어려운 단점이 있다.
수술 중 영상유도장치는 현재 척추경 나사못 삽입 수술에서 가장 표준적으로 널리 쓰이는 실시간 평가 방법이다. 이 장치는 크게 2평면 투시검사(dual-planar 2D fluoroscopy, C-arm)와 3차원 영상검사(intraoperative 3D scan, Iso-C fluoroscopy, O-arm)로 나누어진다. 2평면 투시검사는 C-arm을 이용하며, 척추경 나사못 삽입 시 실시간으로 앞-뒤면(anterior-posterior view)과 측면(lateral view)을 동시에 확인하면서 나사못을 진입시킬 수 있다. 이는 안전하면서도 C-arm만 있으면 쉽게 활용할 수 있어 최소의 준비(set up)로 가장 비용 대비 효율이 좋은 특징이 있다[15]. 3차원 영상검사는 3평면 투시검사나 수술 내 전산화 단층촬영(intraoperative CT scan)을 통해 입체적 영상 재구성을 통해 가장 정확하게 나사못 위치를 평가할 수 있는 방법이다[16,17]. 또한 2평면 투시검사와 마찬가지로 수술자의 판독에 따라 즉각적인 나사못 위치 교정이 가능한 장점이 있다. 그러나 2평면 투시검사와 비교하여 3차원 영상검사 시에는 장비 및 비용적 측면에서 부담이 더 크다는 단점이 있으며, 높은 정도의 방사선 노출에 대한 고려 또한 필요하며, 상대적으로 높은 정확성에도 불구하고 2평면 투시 검사에 비해 활용도가 낮은 특징이 있다[18].
저항검사(impedance test)는 확보된 나사못 삽입 경로의 저항을 측정하여 척추경 벽(pedicle wall) 두께를 평가하는 방법으로 Myers 등 [19]이 제안하였다. 손상되지 않은 척추경 벽 내의 저항은 100±22 Ω 정도이며, 저항 값이 58 Ω보다 낮은 경우 척추경 나사못 삽입 경로내 손상을 의심할 수 있다. 그러나 저항검사의 경우 측정 값의 변동성(variability)이 높으며, 연구 결과 나사못 삽입 경로의 시진(inspection) 및 INM 검사와 상관관계를 보이지 않아 활용도가 높지 않다[20].
모든 척수신경근은 운동과 감각 섬유로 구성되어 있으며, 신경근 기능에 대한 감시는 수술 중에 나타나는 운동 및 감각 반응을 모두 활용할 수 있다. 여러 가지 검사 도구 중 척수신경근 기능 평가에 사용할 INM방식을 선택하는데 있어 고려해야 할 부분들은 다음과 같다.
검사가 용이하며, 특별한 추가 장치나 기술에 대한 요구 없이 기존의 장비 및 인력을 활용할 수 있어야 하며, 검사자가 수행하는데 어려움이 없으면서도 효과적으로 검사 결과를 얻을 수 있어야 한다. 또한 수술의 특성상 검사의 반응이 바로 나타나며, 즉각적인 수술의 수정이 가능한 방법을 선택해야 한다. 마지막으로 검사 결과는 정확하고 신뢰할 만한 것이어야 하며, 환자의 최종 결과(outcome)에 긍정적인 영향을 줄 수 있어야 한다.
운동 유발전위(motor evoked potential, MEP) 및 체성감각 유발전위(somatosensory evoked potential, SEP)는 INM 시 보편적으로 가장 많이 적용되는 검사 도구이지만, 척수신경근 손상을 평가하는데 있어서는 민감도가 높지 않다[21]. 경막외(epidural) 전극에서 기록한 MEP는 원위부(distal)에서 발생한 척수신경근 손상의 영향을 받지 않으며, 개별 사지근육(single distal limb muscle)에서 기록한 MEP는 다른 근분절(myotome)의 손상을 반영하기 어렵다. SEP 역시 척수를 통해 상행하는 여러 감각신경 분절의 누적 신호(summation of signals)를 기록하는 것으로, 개별 신경근(individual nerve root) 손상에도 불구하고, 전혀 변화를 보이지 않을 수 있다[11]. 피부분절 체성감각 유발전위(dermatomal somatosensory evoked potential, DSEP)는 개별 신경근으로부터 신경지배(innervation)를 받는 피부분절의 피하 층 말초신경을 자극하여 SEP반응을 얻는 방식으로 개별신경근을 따로 평가할 수 있다. 그러나 DSEP는 SEP와 달리 더 많은 자극이 필요하며, 높은 변동성(variability) 및 측정의 민감도로 인해 SEP에 비해 상대적으로 일관되고 명확한 반응을 얻기가 어렵고, 특히 수술 장 안에서 시행하는 INM 특성상 전기 신호의 간섭이나 마취의 영향 등으로 인해 더 제약이 많다고 할 수 있다[22].
척추경 나사못 삽입 시 유발전위 검사보다는 근전도 검사가 더 유용하게 활용될 수 있다. 근전도 검사는 개별 신경근 손상에 민감하며, 동시에 여러 부위를 검사하기에 용이하고, 수술자가 즉각적인 수정을 하기에 적합한 장점이 있다. INM에서 적용하고 있는 근전도 검사는 자발 근전도(free-run EMG) 검사와 유발 근전도(triggered EMG) 검사가 있다.
자발 근전도 검사는 수술 시간 동안 연속적인 근전도 반응을 관찰할 수 있으며, 운동단위전위(motor unit action potential, MUAP)를 기록한다. 척수신경근 자극(irritation)이나 손상(injury)이 발생할 경우, 기록 전극이 부착되어 있는 해당 근육에서 고주파수의 신경긴장 방전(neurotonic discharge) 이 기록된다. 주기적이지 않은 짧은 돌발파(short bursts)도 간혹 관찰될 수 있으나, 일반적으로 이것이 신경 손상을 시사하는 경우는 적으며, 주로 당김(tugging), 세척(irrigation), 전기 지짐(electrocautery), 적신 거즈(soaked pledget) 등에 의해 유발될 수 있다. 더 크고 오래 지속되는 긴 반응(long trains)은 지속되는 견인(traction)이나 압박(compression)과 연관되며, 좀 더 높은 가능성의 신경 손상을 시사하여 수술 과정의 즉각적인 중단 및 중재(intervention)를 요한다[11,23].
유발 근전도는 개별 신경근 운동단위전위 기록 및 실시간 나사못 위치 확인을 위해 가장 유용한 검사 도구로, 척추경 나사못 삽입 수술 시 INM의 근간이 되는 검사이다. 수술자가 나사못 삽입 경로를 확보하는 과정이나 나사못을 삽입하는 과정에서 실시간으로 전기 자극을 가하여 복합운동단위(compound muscle action potential, CMAP)의 발생 여부를 확인할 수 있으며, 이를 나사못 경로 수정에 즉각적으로 반영할 수 있다.
유발 근전도를 얻는 방법은 두 가지가 있으며, 직접 신경 뿌리 자극(direct nerve root stimulation, DNRS)법과 간접 신경 뿌리 자극(indirect nerve root stimulation, INRS)법이 있으며, 두 가지 모두 INM에서 유용하게 활용될 수 있다[9,24].
유발 근전도 검사 시 1-5 Hz 범위의 반복 박동성 자극(pulsatile stimulation)을 사용하며, 펄스기간(pulse width)은 50-300 ms으로 한다[25]. 유발 근전도를 통한 신경근 평가를 시행할 때는 항전압성(constant-voltage)이 아닌 항전류성(constant-current)으로 자극을 가해야 한다[26]. 전압(voltage)은 인체 조직이나 도구 등에 의한 저항에 반하여 전자의 흐름을 만들어 주는 유도력(driving-force)로 정의할 수 있으며, 옴의 법칙(Ohm’s law, V = IR)을 따른다. 척추경 나사못 삽입 중 유발 근전도 검사를 시행할 때 척추경 벽 및 척추체의 뼈나 주변 근육, 혈관, 혈액 등이 저항을 형성한다. 이때 골다공증(osteoporosis) 유무 등 각 개인 특성에 따라 저항 값이 달라질 수 있으며, 혈관, 혈액, 체액 저류의 정도에 따라서도 저항의 정도가 달라질 수 있다. 따라서 항전압성 자극을 줄 경우 항전류성 자극에 비해 환자마다 결과의 다양성이 더 커지는 문제를 발생시키게 된다[24]. 따라서 유발 근전도를 평가할 때는 항전류성 자극을 사용한다.
자극프로브(stimulation probe)는 수술 부위에서 전류의 우회(current shunting)를 최소화하기 위해 주로 단극성(monopolar)의 막대형 전극을 사용하며, 자극프로브의 공모양 끝(ball tip)을 자극하고자 구조나 물체에 접촉 후 검사를 진행한다. 단극성 자극프로브를 사용할 때, 단일 바늘 전극(single needle electrode)을 수술 부위 척추옆근육(paravertebral muscle)에 위치시키는데, 자극 전류가 다시 회귀(return)하는 경로를 제공해준다.
기록 전극(recording electrode)의 경우, 수술 전 검사자가 수술의 부위(level) 및 기록의 용이성 등을 고려하여 감시하고자 하는 근육들을 선택하며, 이것은 일반적인 신경근 지배에 따른다(Table 1). 표면 바늘 전극(subdermal needle electrode)을 이용하여 기록하며, 대부분 수술 중 해당 근육에서 자발 근전도도 같이 기록한다.
자극세기는 0 mA에서 시작하여, CMAP 반응이 나오는 시점까지 서서히 증가시키는 방식으로 진행하며, 최대 자극세기를 설정하여 환자의 안전을 보장해야 하고, 일반적으로 30-50 mA로 설정할 수 있다[25]. 기록 기간(time base)은 10 ms/div, 통과 구간(filters)은 10-10,000 Hz, 민감도(gain)는 50 µV/div 으로 설정한다[11].
DNRS법은 주로 나사못 삽입 부위의 척수신경근에서 자극 역치(stimulation threshold)를 결정하는데 유용하게 사용된다. DNRS 자체가 직접적으로 나사못의 잘못된 위치를 시사할 수 있는 검사 방법은 아니며, INRS와 결합하여 적절한 자극 역치를 알고 있는 상태에서 INRS 결과를 정확하게 해석할 수 있게 도와주는 역할을 할 수 있다. DNRS은 INRS와 달리 저항의 영향을 거의 받지 않으므로, 여러 번의 검사에도 일정한 결과를 얻을 수 있다[27].
건강하고 정상적으로 기능하는 척수신경근의 경우, 낮으면서도 일관된 자극 역치에 반응을 보이지만, 만성적으로 압박된 신경근이나 당뇨, 고혈압, 알코올중독, 흡연 등과 같이 말초 신경 전도에 영향을 줄 수 있는 기저 질환이 있는 경우 더 높은 정도의 자극 역치가 필요하다[28,29]. 특히 요천추에서 척수경 나사못 삽입 수술을 시행하는 경우 대부분 퇴행성 척추 질환에 의한 수술이 많으며, 이런 경우 만성 압박을 받고 있는 신경근에서 상대적으로 높은 자극 역치를 보일 뿐만 아니라, 같은 환자의 다른 척수신경근 간에도 자극 역치의 다양성을 보일 수 있다[30]. 이러한 사실을 간과한다면 INRS상 위음성(false- negative) 결과를 얻을 수 있으며, 실제 신경근 손상이 발생하더라도 적절하지 못한 자극 역치 범위 설정으로 인해 수술 장 내에서 즉각적인 수정이 이루어지지 않을 수 있다. 이처럼 DNRS법은 신경계 감시의 정확도를 높일 수 있는 의미 있는 과정이라 할 수 있지만, 촉감확인법과 마찬가지로, 척추 후방 부위 개방 없이 경피 나사못 삽입을 시행하는 척추고정술의 경우 활용이 어려운 단점이 있다.
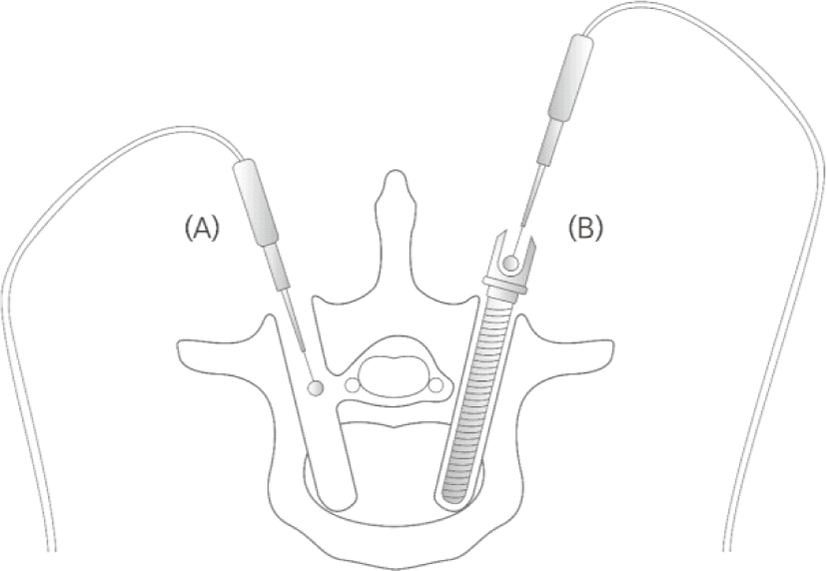
INRS법은 나사못 삽입 경로의 자극(insertion tract stimulation, ITS), 나사못 직접 자극(pedicle screw stimulation, PSS)을 모두 포함하는 개념이다(Fig. 1). 이처럼 나사못 삽입 시 일련의 모든 과정에서 전기 자극을 주어 척수신경근의 반응을 확인할 수 있는데, 이것이 모두 INRS법에 해당한다[10,31]. ITS 시 신경근이 가장 가깝게 지나는 척추경 중간부(mid-pedicle)에서 자극하는 것이 중요하며, 유도철사 자극이나 PSS를 시행할 때는 자극프로브와 장치 간의 접촉이 정확하게 된 상태에서 자극이 들어가는지 반드시 확인해야 한다[32].
앞서 언급한대로 척추경 나사못 삽입 시 신경 손상의 위험이 늘 존재한다. 안정성의 문제는 의료진과 환자 모두에게 가장 중요하게 고려되는 요소인 만큼 INM을 비롯하여 여러 검사 방법들에 대한 많은 연구와 더불어, 각 검사 간의 비교 연구 또한 활발하게 진행되고 있다.
현재 척추경 나사못 삽입 수술에서 가장 보편적으로 쓰이는 검사 방법은 수술 중 영상 유도 장치이다. 대부분의 연구에서 3차원 영상검사가 2평면 투시검사나 촉감확인법에 비해 나사못 위치 이상의 진단 정확도가 우월하다고 보고하고 있다[33]. 그러나 3차원 영상검사는 방사선 노출이 많다는 단점이 있으며, 수술 시간의 경우 다른 검사와 비교하여 특별히 더 길어지지 않는 것으로 확인되었다[34,35].
INM과 다른 검사를 비교한 연구를 보면, PSS가 투시검사나 촉감확인법에 비해 우월하다는 결과가 있으며, 3차원 영상검사와 비교에서는 영상검사가 PSS에 비해 나사못 위치 이상에 대해 더 진단의 정확도가 높은 것으로 보고되고 있다[36,37]. 그러나 영상 진단 기법도 완전한 방법으로 볼 수는 없으며, 영상을 통한 3차원적 위치 확인에는 더 유리하나, 실제로 위치 이상이 신경학적 손상과 연관되는지 직접 확인하기는 어렵다. 또, 위치상 문제가 없어 보인다 할지라도 신경근에 가깝게 삽입된 나사못에 의해 신경근 자극을 받을 수 있다. 반면 INM은 신경 생리적 반응을 볼 수 있어 실제적인 신경 손상 유무를 확인할 수 있는 장점이 있다. PSS와 ITS를 비교한 연구에서는 ITS가 PSS에 비해 위음성율이 월등히 낮았으며, 이는PSS시 전류의 전달을 방해하는 변수들이 많은 것이 원인으로 보인다[32].
척추경 나사못이 의도된 부위로 적절하게 위치하지 못했을 경우, 전기 자극을 통해 즉각 확인하는 것이 신경계 감시의 주 목적이지만, 실제 임상에서 적용해 보면 결과 해석에 어려움을 주는 여러 가지 요소들이 있으며, 여기에는 기술적, 생리적 요소가 모두 작용한다. 이러한 변수들은 성공적인 수술 및 환자의 안전에 위협이 되는 중요한 부분이다. 지금부터는 INM 적용 시 주의해야할 함정(pitfall) 및 결과 해석에 고려되어야 할 변수들에 대해 고찰하고자 한다.
일반적으로 낮은 자극 역치에 반응을 보일수록 나사못이 잘못된 위치로 삽입되었을 가능성은 높아진다. 그러나 어느 정도의 자극 세기로 검사를 했을 때 그 결과를 신뢰할 수 있는지, 여러 환자의 다양한 신체적 상태, 수술 방법의 차이, 기술적 요소 등에 맞추어 일관되게 적용할 수 있는 자극 역치 값은 얼마인지에 대한 것은 지속적으로 논의되고 있다. 그러나 여러 연구에도 불구하고 여전히 결과 값의 다양성 및 논쟁이 존재한다[6,38,39]. Raynol 등 [40]은 PSS시 자극 세기에 따른 나사못 위치 이상의 가능성(probability) 차이를 확인한 바 있으며, 2.8 mA보다 낮은 자극 세기에서는 100% 나사못 위치 이상이 있을 수 있다고 보고하였다. 이처럼 자극 역치에 따라 달라지는 결과로 인해 각각의 증례(case)에 따라 신경계 감시를 시행하는 인력과 수술 인력의 협의 하에 수술 장 내에서 적절한 판단을 내리는 것이 중요하다.
자극 역치에 다양성이 존재한다는 것은 결과의 신뢰도가 떨어질 수 있음을 의미한다. 민감도와 특이도를 연구한 여러 문헌을 고찰해 보면, 특히 민감도가 특이도에 비해 낮은 결과를 보였으며, 당연하게도 자극 역치에 따라 민감도와 특이도가 달라지는 양상을 보였다[41-43]. Mikula 등 [43]의 연구에서 자극세기를 7-9 mA로 설정하였을 때 가장 높은 민감도를 보였으나, 10-12 mA의 자극 세기에서 가장 높은 특이도를 보였으며, 대체로 높은 특이도에 비해 낮은 민감도를 보였다. 다른 보고에 의하면 요천추 나사못 삽입 시 8 mA의 자극 강도에서 가장 좋은 민감도(0.82) 및 특이도(0.97)을 보였으나, 역시 상대적으로 특이도에 비해 낮은 민감도를 보이고 있으며, 흉추에서는 6 mA의 자극 세기에서 허용가능한(acceptable) 특이도(0.96)를 보였으나, 낮은 민감도(0.43)로 인해 검사 자체의 신뢰도가 낮음을 보고하였다[38]. Kulkit 등 [44]의 연구에서는 10 mA의 자극 세기로 PSS를 시행했을 때 흉추, 요추에서 각각 24%, 15%의 위음성율을 보였다. 이처럼 낮은 민감도로 인해 위음성 결과를 보이게 될 경우, 환자는 돌이킬 수 없는 신경 손상에 노출될 수 있으며, 따라서 결과에 영향을 줄 수 있는 요소들에 대한 면밀한 고찰을 통해 검사상 오차(error)를 줄일 수 있도록 최대한의 노력을 기해야 한다.
퇴행성 질환에 의해 만성 압박을 받고 있는 신경근의 경우, 정상 척수신경근에 비해 더 높은 자극 역치가 필요하다[30]. 201개의 요천추 부위 척수신경근을 DNRS법으로 검사한 연구가 있었으며, 이 연구에서 저자들은 영상학적, 전기진단학적 검사를 토대로 만성 압박을 받고 있는 신경근과 정상 신경근을 나누어 각각의 평균 자극 역치 값을 측정하였다. 결과적으로 요천추 부위 척수신경근의 전체 평균 자극 역치는 6.34 mA, 정상 신경근의 평균 자극 역치는 4.33 mA, 만성 압박을 받는 신경근의 평균 자극 역치는 11.93 mA로 차이를 보였다[28]. 실제로 수술 방 내에서 DNRS을 진행해 보면 같은 환자에서도 부위에 따라 신경 압박의 정도가 다르며, 전기진단 검사상 탈신경(denervation) 소견을 동일하게 보이더라도 부위나 좌우 위치에 따라 각각의 신경근 자극 역치는 다양함을 알 수 있다. 따라서 수술 전 신경학적 검사, 영상학적 검사 및 전기진단 검사를 통해 척수신경근의 압박 여부를 반드시 확인해야 한다. 또한 척추경 나사못을 삽입하고자 하는 부위의 DNRS를 시행하는 것은 INM의 정확도를 높일 수 있는 중요한 과정으로, 척추 후방 개방이 동반된 척추경 나사못 삽입 수술에서는 시간적 부담에도 불구하고, 반드시 고려되어야 한다.
환자가 대사 질환을 갖고 있는 경우 자극 역치 값이 올라갈 수 있다[28]. 당뇨는 대표적으로 말초 신경계에 영향을 줄 수 있는 질환이며, 전반적인 말초신경병증(polyneuropathy)이 있을 경우, 더 높은 자극 세기에서 원하는 CMAP을 얻을 수 있어 위음성 결과에 주의해야 한다. 당뇨 외에도 고혈압, 고지혈증, 알코올중독, 흡연 등의 기저 질환에 대해 미리 확인하고, 수술 전 전기진단 검사 등 사전 검사 및 DNRS를 통한 정확한 자극 역치의 확인이 중요하다.
반대의 경우도 고려해야 하는데 환자가 골다공증을 갖고 있거나, 피질골(cortical bone)이 얇은 경우 오히려 자극 역치를 낮출 수 있어 위양성(false-positive) 결과를 보일 수 있다.
INM이 적용되는 모든 수술에서는 공통적으로 마취와 근이완을 고려하여야 한다. 근이완 상태에서는 MUP나 CMAP이 유발되지 않을 수 있으며, 위음성 결과로 이어지게 된다. 유발 근전도를 시행할 때 근이완 정도는 자극 역치에 지대한 영향을 미치는 요소로 전기 자극 전에 근이완에 대한 정확한 평가는 필수적인 요소이다. 특히 자발 근전도에 비해 유발 근전도를 얻을 때에는 근이완의 정도가 더 결정적으로 결과에 영향을 줄 수 있다. 일정한 자극 역치를 통해 신뢰할 만한 검사 결과를 얻을 수 있는 근이완의 정도에는 논란이 있으며, 신경 근육 차단제(neuromuscular blockade)를 가능한 사용하지 않는 것이 필요하지만, 효과적인 자발 근전도와 유발 근전도 감시를 위해서 신경 근육 차단(neuromuscular blockade)을 완전히 배제할 필요는 없다[45].
사연속반응(Train-of-four) 검사는 근이완 상태를 평가하는 가장 일반적인 방법으로 검사 시 4개의 수축(twitch) 반응이 모두 유발되어야 하며, 네번째 수축과 첫번째 수축의 진폭의 비가 최소 0.1 이상일 때 의미 있는 유발 근전도 검사 결과를 얻을 수 있다[46].
INRS 시 우선 척추경 벽, 유도 철사, 나사못 등 접촉 자극을 가하는 부위에 먼저 전류가 흐르게 되고, 그것이 적절한 수준 이상의 자극이 되었을 때 전류의 흐름을 통해 척수신경근의 탈분극이 일어난다. 잘못 위치한 나사못에 의해 척추경 벽의 연속성에 문제가 생기면 그 부위를 통해 전류가 쉽게 흐르게 되며 적은 양의 전류로도 척수신경근을 자극할 수 있다. 전류는 늘 저항이 낮은 곳을 향해 흐르는 성질이 있으며, 척추경 벽의 파손이 심할수록 더 낮은 저항을 형성한다[47].
그렇지만 우리 생체 내에서 위와 같은 전류의 흐름이 늘 일정하게 일어나는 것은 아니다. 수술 부위 주변으로 액체 저류가 많을 경우 액체가 나사못과 접촉하게 되고, 액체는 낮은 저항을 형성하여 우회 경로로 작용하게 된다. Skelly 등 [26]의 연구에서 수술 부위의 젖은 상태(wet condition)와 마른 상태(dry condition)에서 각각 PSS를 시행하였을 때 젖은 상태에서 일관되게 높은 자극 역치가 형성됨을 확인하였으며, 저류 된 액체가 일부 사이길(shunt)로 작용함을 확인하였다. 수술 중 전기 자극을 가할 때, 나사못 주변의 환경을 마른 상태로 유지하여 위음성을 줄이는 노력이 필요하다.
현재 사용되고 있는 척추경 나사못은 주로 티타늄(Titanium) 과 알루미늄(Aluminum) 합금 재질로 강도가 높아 안정성을 확보해 주며, 자기공명영상(MRI) 검사 시 허상(artifact)을 최소화할 수 있어 수술 후 추적 검사 시에도 유리하다.
그러나 티타늄은 전도체(conductor)로서는 좋지 않은 물질로 전도율이 매우 낮으며, 티타늄 층의 두께에 따라 나사못의 저항이 다양해질 수밖에 없다. 일부 나사못 종류는 Hydroxyapatite 재질로 감싸져 있으며, 역시나 나쁜 전도체로 작용하여 저항 값에 영향을 준다[48,49]. 또한 나사못의 크기도 영향을 주는데, 크기가 클수록 저항이 큰 특징을 보여 일관된 자극 역치를 적용하기 어렵게 하는 요인이 된다[50].
또, 한가지 주의할 것은 자극프로브와 나사못이 충분히 접촉되는지 꼭 확인해야 하며, 다축 나사(polyaxial screw)에서 막대(shank) 부분에 비해 구형 머리(mobile crown) 부분의 저항이 더 높게 형성되므로, 위음성율을 낮추기 위해서는 나사못 막대 부분에 자극프로브가 완전히 접촉될 수 있도록 해야 한다[47].
결론
척추경 나사못 삽입 수술에서 INM의 적용은 나사못 위치 이상의 즉각적인 수정을 가능하게 하며, 결과적으로 신경학적 합병증을 예방할 수 있는 좋은 도구이다. 그러나 여러 장점에도 불구하고, 여전히 비용, 시간적인 부담에서 자유로울 수 없으며, 위음성 결과 및 낮은 민감도로 인해 결과의 신뢰성에 의문이 지속적으로 제기되고 있다.
현재 국내에서는 나사못을 이용한 척추고정술 시 INM이 일반적으로 적용되고 있지는 않으며, INM을 대체할 수 있는 수술 중 영상 유도 장치가 더 광범위하게 적용되고 있다. INM은 신경 생리적 신호를 감지할 수 있기 때문에 영상학적 검사와는 구별되는 장점이 있으며, 따라서 INM과 수술 중 영상 유도 장치를 동시에 적용한다면 더 높은 정도의 환자 안전을 보장할 수 있을 것이다. 향후 추가 연구를 통해 INM과 수술 중 영상 유도 장치를 비롯한 다른 검사 방법을 통합하여, 척추경 나사못 삽입 수술에서 적용 가능한 일관된 감시 프로토콜(protocol) 을 제시할 수 있기를 기대해 본다.







