서론
수술중신경계감시(intraoperative neurophysiological monitoring, INM)는 수술 도중에 신경계 손상을 방지 혹은 이를 빨리 감지하기 위하여 신경생리학적 검사를 시행하는 방법이다. 이 중에서도 운동유발전위(motor evoked potential, MEP) 및 체성감각유발전위(somatosensory evoked potential, SSEP) 검사를 주로 이용한다[1,2]. MEP는 전형적으로 SEP보다 척수허혈(spinal cord ischemia) 혹은 수술조작(manipulation)에 민감하다고 알려져 있다[3]. 대부분의 증례에서 MEP가 변화한 후 SEP 변화가 따라 온다. 일부 환자에서는 MEP 변화가 있음에도 SEP는 변화 없이 유지되는 경우도 있다[4]. 변화가 MEP가 먼저 일어나는 경우가 많은 것처럼 회복될 때도 MEP 회복이 빠르다. 이처럼 일반적으로 MEP가 SEP보다 민감한 변화를 보이는 경우가 많다. 또한 SEP 변화 유무와 상관 없이 MEP의 회복은 좋은 예후와 연관이 있다고 보고되었다[5].
저자들은 최근 MEP의 의미 있는 변화 없이 SEP의 변화를 보인 척수종양제거술 INM 증례를 경험하여 보고하고자 한다.
증례
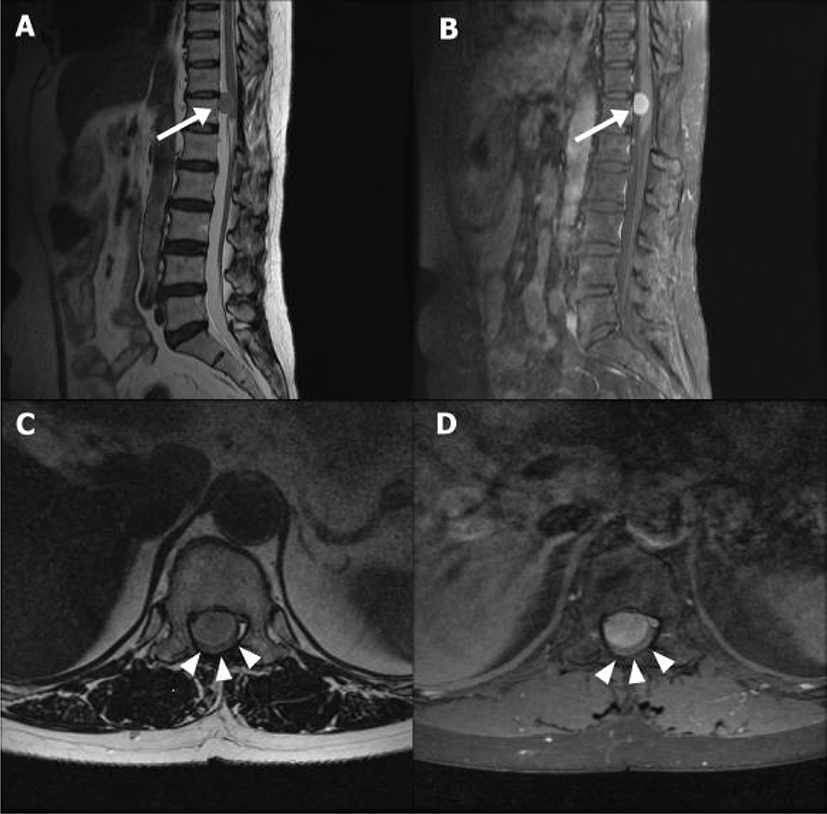
63세 남자로 수개월부터 시작된 요통 양하지 위약감을 주소로 내원하였다. 6년전 교통사고 후 시행한 척추 MRI에서 T11, 12 위치의 척수 수막종이 발견되어 제거 수술을 하였으며, 이후 특이 증상 없이 지내왔다. 내원 10년전 고혈압을 진단 받고 약물치료 중이었고, 당뇨 및 근신경계 질환 등 다른 병력은 없었다. 배뇨장애는 없었으며, 약간의 변비를 호소하였다. 신경학적 검사에서 우측 근력은 정상이었으나, 좌측 엉덩관절 폄, 굽힘, 외전 및 내전, 무릎관절의 폄, 굽힘이 Medical Research Council(MRC) 등급 Ⅳ, 발바닥쪽굽힘, 발등굽힘, 발목 내번 및 외번, 발가락 굽힘 MRC Ⅲ로 근력 감소가 있었다. 양측 무릎뼈 아래 10 cm에서 측정한 다리 굵기는 각각 35 cm로 양측 차이는 없었으며, 근 긴장도는 정상이었다. 양발바닥의 시린감, 간헐적인 요통을 호소하였으나, 감각 검사에서는 이상소견이 없었다. 심건반사에서는 양측 발목, 슬개건 반사가 항진되었다. 바빈스키증후, 발목간대는 없었고, 운동 조화 및 소뇌기능검사는 정상이었다. 요추 자기공명영상을 시행하였고, T2 sagittal 강조 영상에서 경막내골수외종양(intradural-extramedullary tumor)이 T11, 12 수준(level)에서 척수 앞쪽에 위치한 것을 확인하였다(Fig. 1). 종양은 과거 수막종이 재발한 것으로 판단하였으며, 21×16×14 mm (craniocaudal ×transverse×anterior-posterior dimension) 크기로 경막내주머니(thecal sac) 배쪽(ventral portion)에 위치하여 척수를 심하게 압박하고 있었다. 척추전문 주치의는 후방접근(Posterior approach)으로 종양제거술(tumor removal) 을 결정하였다. 환자는 엎드린자세(prone position)로 마취는 프로포폴(propofol)과 레미펜타닐(remifentanil)을 사용하여 완전정맥마취(total intravenous anesthesia)를 시행하였다. INM은 상하지 MEP, SEP와 Train of four, 자발근전도(spontaneous EMG)를 기록하였다. TOF는 양측 정중신경을 이용하여 짧은엄지벌림근(abductor pollicis brevis muscle)에서 기록을 하였고, SSEP는 양측 정중신경과 후경골신경을 자극하고 C3’-C4’, C4’-C3’에서 기록하였다. 자극 크기는 상지는 20 mV, 하지는 30 mV로 하였고, 자극빈도는 2.9 Hz, 평균화 횟수는 50번으로 하였다. MEP는 두개경유전기자극(transcranial electrical stimulation) 방식으로 C3-C4 위치에서 400 volt의 5번 반복 펄스를 이용 자극하여 양측 짧은엄지벌림근, 정강앞근육(tibialis anterior), 무지외전근(abductor halluces muscle)에서 기록하였다(장비명: Neurophysiology monitor, intraoperative, Eclipse, AXON). 마취 유도(induction) 후 SEP와 MEP의 기준값(baseline)을 얻었다(Fig. 2).
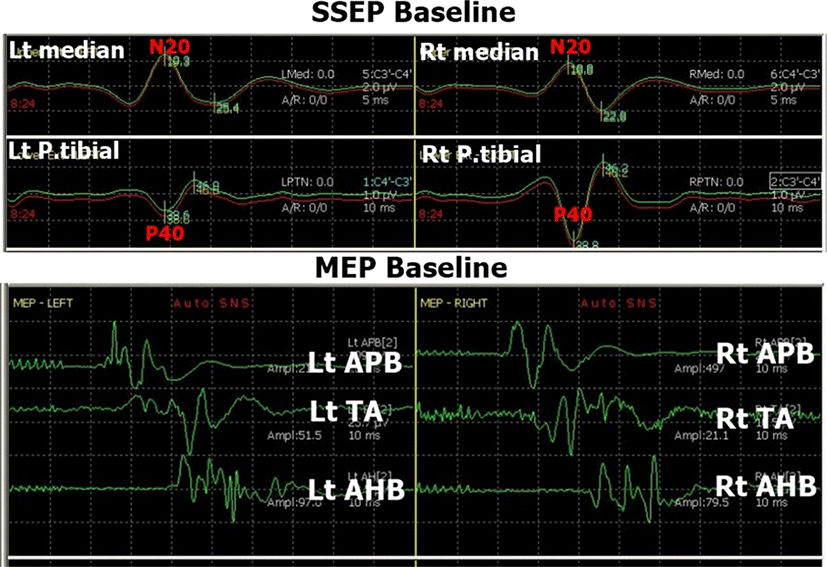
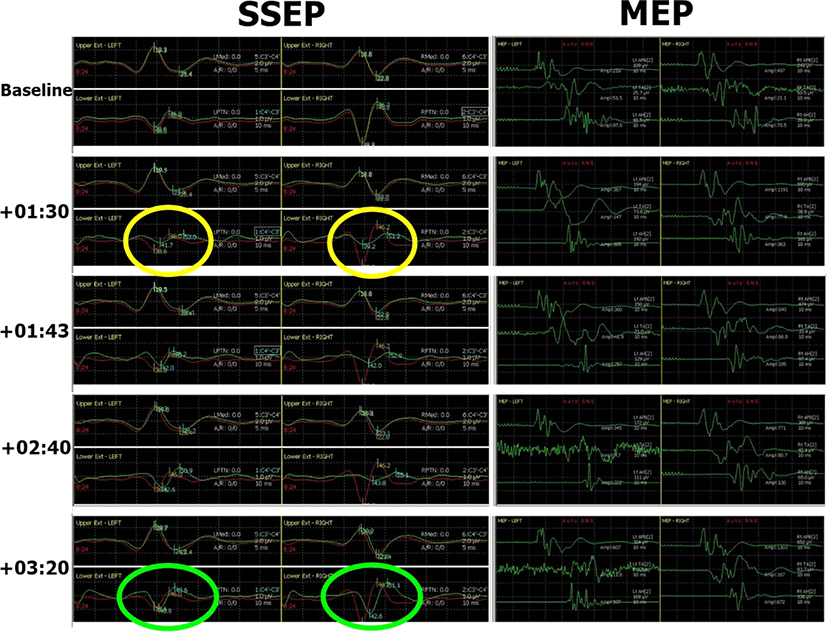
수술 시작 +1시간 30분 후 경질막(dura)을 척수를 따라 긴 방향으로 절개를 시행하여 수술 중 양측 후경골신경 SEP에서 P40 파형의 진폭감소를 확인하였다. 좌측 P40 파형 진폭은 기준값(baseline)의 52.9%(1.1 μV → 0.6 μV), 우측 P40은 26.4%(2.9 μV → 0.77 μV)로 줄어들었다(Fig. 3). P40의 지연(latency)은 좌측이 8% 증가(38.6 ms → 41.7 ms), 우측이 1% 증가(38.8 ms → 39.2 ms)하였다. 동 시간대의 MEP는 기준 진폭에 비해 감소는 없었으며, 오히려 수술 초기 진폭보다 증가된 양상이었다. 상기 변화를 집도의에게 정보 제공하였으며, 종양제거술은 예정대로 진행하였다. 그로부터 13분 후(+1시간 43분) 다시 측정한 후경골신경 SEP에서 좌측 P40 파형의 진폭은 1.0 μV로 기준 값(1.1 μV)을 거의 회복하였으나, 우측 P40 파형은 0.75 μV로 기준값(2.9 μV)의 25.7%로 회복 없이 유지되었다. 5-10분 간격으로 반복 측정한 우측 P40의 진폭 감소 변화는 1시간 40분 가량 지속되다가 수술을 마무리 하면서 서서히 회복되어 종료 시점(+3시간 20분)에 우측 P40의 진폭이 기준 값의 75.9% 양상을 보이며 종료하였다. 수술 후 환자의 좌측 하지 근력은 근위부 MRC Ⅲ, 원위부 MRC Ⅱ 정도로 감소를 보였으나, 2-3일 걸쳐 호전되어 수술 전 수준까지 회복되었다. 감각이상으로는 우측 하지 저림을 호소하였고, 무릎 이하 특히 우측 발바닥 저림을 호소하였으나, 경과 관찰 중 서서히 호전 양상을 보여 수술전보다 좋아진 상태로 퇴원하였다.
고찰
상기 환자는 T11, T12 위치에서 발생한 경막내골수외종양이 척수의 앞쪽을 압박하여 하지위약과 이상감각을 초래하였다. 후방접근을 통해 경질막을 열고 종양 제거하는 수술로 계획하였고, 경질막을 박리하며 접근 중 수술중신경계 감시에서 갑작스러운 양하지의 후경골신경 SEP의 P40 파형에 의미 있는 변화가 발생하였고, 좌측 P40 파형은 곧 회복되었으나 우측 P40 파형의 진폭감소는 1시간 40분 동안 지속 후 수술 종료 전 회복되었다. 반면, 후경골신경 SEP의 변화 도중 측정한 MEP에서는 의미 있는 변화는 없었다. 수술 후에는 수술 전 존재했던 좌측 하지의 위약이 며칠간 악화되었다가 회복되었고, 우측 하지 특히 무릎 이하 발바닥 부위의 저림을 호소하다가 경과 관찰 중 호전되었다.
경막내골수외종양은 경막내척수종양의 대부분을 차지하며, 수막종이 가장 흔한 종류이다[6]. 일반적인 척수 수술에서의 수술중신경계 감시의 방법은 SEP와 MEP 모니터링이다[7,8]. MEP 모니터링으로는 두개경유전기자극 후 말단 근육의 복합근활동전위(compound muscle action potential)를 기록하는 방법과 자극 후 척수신경에서 직접 기록하는 D wave 방법이 있으나, 본 환자의 MEP 모니터링은 복합근활동전위 기록 방식만 이용하였다. 수술중신경계감시에서의 초기 기본값(baseline)은 정중신경 SEP, 후경골신경 SEP, 양상하지의 MEP를 뚜렷하게 얻을 수 있었고, 이를 이용해 적절한 INM을 수행할 수 있었다. SEP의 알람기준(waring criteria)은 다양한 기준이 제시되고 있으나, 일반적으로 진폭의 50% 이상의 감소, 지연의 10% 이상 연장을 기준으로 한다[9]. MEP에서는 복합근활동전위의 크기변화를 측정하는데 검사실마다 진폭 감소의 기준이 30%-100%로 다양하다[10]. 또한 유발전위의 변화가 체온, 혈압, 산소포화도 등의 전신인자에 의한 경우 일반적으로 서서히 진행하는 경우가 많고, 수술에 의한 신경손상이나 체위변화로 인한 신경압박, 허혈 등에 의한 직접적인 신경손상들은 갑작스레 빠르게 변화하는 경향을 보인다. 상기 환자는 흉추 위치의 종양 제거 수술이기 때문에 수술로 인한 신경손상 발생은 상지쪽 유발전위 값의 의미 있는 변화 없이 하지 쪽 유발전위만 변화가 있을 것으로 예상할 수 있다. 실제 하지 쪽에서만 의미 있는 유발전위 값의 변화가 발생하였고(양측 P40 파형), 상지의 유발전위값(양측 N20)의 변화는 없었다. 또한 경질막을 여는 과정에서 상지 SEP와 상하지 MEP의 유의한 변화 없이 하지 SEP 유발전위 값만 갑작스러운 변화를 보여 이를 종합하여 볼 때 전신인자나 인공적 오류(artifact error) 가능성보다는 수술과 연관된 요소로 척수 신경에 직접적인 영향을 주었을 가능성이 높다. 허혈로 인한 변화는 SEP보다는 MEP에 더 영향을 많이 주기 때문에 SEP만 변화를 보였던 본 증례와는 맞지 않는다[3]. 결국 후방접근을 통해 경질막을 박리하면서 척수의 후면부에 위치해 있는 등쪽기둥(dorsal column)에 직접적인 영향을 끼쳤을 것으로 추측할 수 있다(Fig. 4). 다른 가능성으로는 종양이 척수의 배쪽(ventral)에 위치하기 때문에 종양제거를 위해 척수를 한쪽 방향으로 치워야 할 때 신경뿌리(nerve root)들이 당겨지며 유발전위의 변화를 초래할 수 있겠다. SEP의 변화기록을 볼 때 우측 하지 SEP 변화가 좌측보다 심한데, 수술시야 확보를 위해 척수를 좌측으로 당기며, 우측 SEP에 더 많은 영향을 주었을 가능성이 있다(Fig. 3).
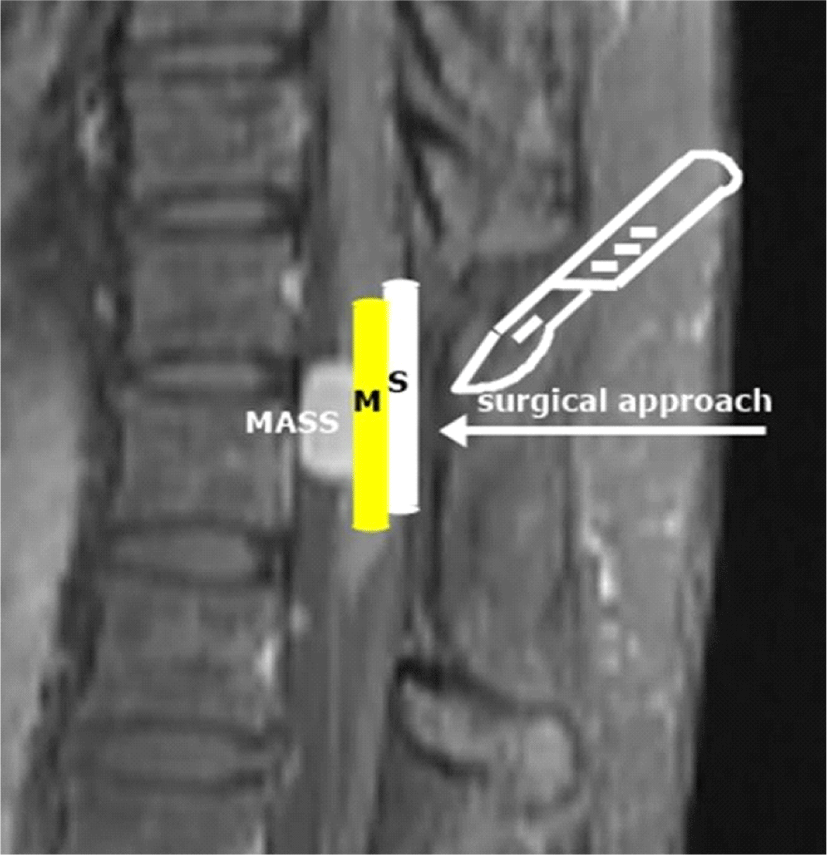
수술 후 환자는 우하지 저림을 호소하였고, 이는 수술 중 우측 SSEP P40 파형 변화와 일치한다. 또한 수술 종료시점 P40 파형의 회복이 되었고, 이는 나은 예후를 암시하고 환자의 실제 감각 증상도 호전되었다.
저자들은 MEP 변화 없이 SEP 변화를 보인 척수 종양 제거술 INM을 경험하였다. MEP가 SEP보다 예민하고 빠른 변화와 빠른 회복 양상을 보이는 것으로 알려져 있지만, 이는 일반적인 경우로 개별 환자에게 적용하기 위해서는 종양의 위치나 수술방법, 발생 가능한 신경손상을 고려하여 이를 예측하고 주의 깊게 INM을 시행해야 할 것이다.







