서론
수술중 신경생리감시는 수술 중 신경학적 손상을 최소화하고, 중요한 신경구조물을 확인함으로써 수술 후 신경학적 장애를 최소화하기 위해 사용된다[1]. 이를 위해 가장 흔히 쓰이는 기법은 신경계를 자극한 후, 이에 따른 신경계 활동으로 발생한 전위를 측정하는 유발전위(evoked potential)이다. 운동유발전위, 체성감각유발전위, 뇌간청각유발전위, 시각유발전위 등이 흔히 사용되는데, 이 중 운동유발전위와 체성감각유발전위는 전기자극을 사용한다. 직접전기자극은 신경구조물의 확인을 위해서도 흔히 쓰인다. 따라서 전기자극과 전기기록의 원리, 그리고 신경계에서 전위가 어떻게 형성되고, 어떻게 기록되는지에 대한 이해가 밑바탕되어야 효율적이고 안전한 수술중 신경생리감시의 시행과 적절한 해석이 이루어질 수 있다. 본 종설에서는 수술중 신경생리감시를 위한 전기자극과 전기 활동 기록의 원리에 대해 소개한다.
전기자극은 수술중 신경생리감시에서 가장 흔히 쓰이는 자극이다. 대표적인 형태는 피부를 통한 말초신경 혹은 뇌신경 자극, 운동유발전위를 위한 경두개전기자극, 신경계 구조물 확인을 위한 직접전기자극 등이다. 전기에너지[E, 단위는 joule (J)]는 일정 시간 동안 가해진 전력이며, 전위차의 크기, 즉 전압[V, 단위는 volt (V)]과 전하의 양[Q, 단위는 coulomb (C)]으로 결정된다: E = Q × V. 전력[P, 단위는 watt (W)]은 단위시간당 가해진 전기에너지인데, 단위시간당 흐르는 전하의 양이 바로 전류[I, 단위는 ampere (A), 1A = 1 C/s]이기 때문에 전력은 전압과 전류의 곱이다: P = E/t = (Q × V)/t = Q/t × V = I × V.
전기자극에 따른 신경 조직의 자극 정도를 결정하는 것은 어떤 양의 전류가 신경조직을 통해 흐르는가이다[2]. 전류가 흐를 때는 항상 흐름에 대한 저항(R, 단위는 ohm)이 나타난다. 저항의 전후로는 전위의 차, 즉 전압이 형성된다. 동일한 전류를 가하기 위해 필요한 전압은 저항이 커질수록 커진다: V = I × R (옴의 법칙). 전기자극은 정전류와 정전압의 두 가지 형태로 가할 수 있는데, 정전류 자극의 경우 저항의 변화에 따라 전압을 조절하여 일정한 전류가 흐르게 하는 반면, 정전압 자극은 전압이 고정되어 있기에 전극과 조직 사이 혹은 조직내의 저항이 변하면 목표한 신경조직에 가해지는 전류도 변한다.
수술중 신경생리감시 환경에서는 자극을 가하는 전극과 목표 신경 조직 사이에 여러 인자들에 의해 전류의 양이 변화할 수 있다. 정전류 자극과 정전압 자극 중 어떤 방법이 적절한지는 상황에 따라 다르다. 전극의 임피던스(impedance)가 변할 수 있는 상황에서는 저항의 변화와 무관하게 일정 전류를 공급하는 정전류 자극이 더 적절하다. 그러나 자극이 전달되는 경로에 저항이 낮은 액체 등 전류가 션트(shunt)될 수 있는 물질이 있다면 정전류 자극에 의한 전류의 상당량이 이러한 우회 경로를 통해 흘러버려 목표한 신경조직에 충분한 전류를 전달하지 못한다. 피부의 전극을 통해 말초신경을 자극하는 경우, 피부의 전극의 임피던스는 변하는 성향이 있지만, 인접한 신경과 전극 사이에 션트의 우려는 적다. 따라서 말초신경은 정전류 자극을 가하는 것이 바람직하다. 두개골을 통해 뇌를 자극하는 경우에는 뇌척수액에 의해 션트가 형성될 수 있는데, 수술 중에는 조직 주위의 뇌척수액이 지속적으로 변화하기 때문에 신경조직에 전달되는 전류의 양을 일정하게 유지하기 어려울 수 있다. 이런 경우, 정전압으로 자극을 가하면 좀 더 안정적으로 전류를 전달할 수 있다. 직접피질자극이나 직접피질하자극, 직접뇌신경자극 등에서는 주변 뇌척수액 등의 상태에 따라 정전류 자극이나 정전압 자극을 선택할 수 있다.
전류란 도체에서 가해전 전위에 따라 전자(electron)가 흐르는 것이다. 비록 전류가 전자의 흐름이고, 전자는 음전하를 가지고 있기 때문에 전위장에서 전자는 음전하를 띈 곳에서 양전하를 띄는 곳으로 흐르지만, 전통적으로 전류는 전자의 흐름과 반대로 양전위에서 음전위로 향하는 양전하의 흐름으로 표현한다. 전기자극을 위한 전극은 전류가 나오는(source) 애노드(anode)와 전류가 흡수되는(sink) 캐소드(cathode)로 나뉜다. 캐소드는 전류를 흡수하여 전극 주위에 음전위를 형성한다. 축삭(axon) 주변 조직에 음전위가 형성되면 축삭 내부는 상대적인 양전위가 되어 탈분극(depolarization)이 일어난다. 따라서 캐소드 자극은 흥분성이라 할 수 있다[3]. 가까운 곳에 두개의 전극이 위치한 두극(bipolar) 전극을 신경 경로를 따라 부착하고 자극을 가할 경우, 캐소드는 흥분성으로 자극하는 반면, 애노드는 축삭 주위의 양전위를 가중시켜 축삭 내부는 상대적으로 음전위가 되는 일종의 과분극 상태가 유발되어 활동 전위 형성을 억제하는데, 이를 애노드 차단(anodal block)이라 한다. 이를 통해 부분적으로 활동 전위를 한쪽 방향으로 유도할 수 있다. 그러므로 말초신경에 전기자극을 가할 때에는 캐소드를 기록 전극쪽으로 향하게 한다.
운동유발전위 형성을 위한 경두개 전기자극은 신경의 자극 보다 복잡한 문제이다. 자극 전극과 목표 신경조직 간의 거리가 멀 뿐만 아니라, 피부, 두개골, 뇌척수액, 뇌의 복잡한 구조와 비등방성으로 인해 실제 어느 부위로 최대 자극이 이루어지는지 알기 어렵다. 원숭이를 대상으로 한 연구에서 캐소드 자극에 대한 피질척수로 활성이 애노드 자극에 비해 더 큰 변동성을 보였고, 뇌 모델을 이용한 수학적 분석에서 애노드 자극이 근접한 신경세포들의 자극에 효율적이었고, 캐소드 자극에 비해 더 낮은 역치를 보인 바, 현재로서는 애노드 자극이 더 효율적이라 받아들여지고 있다[4–6]. 두개내 자극의 경우, 피질을 자극할 때에는 애노드 자극이 더 효율적인 반면, 피질척수로 등 피질하 자극에는 캐소드 자극에 더 효율적이다[7].
전기자극은 짧은 펄스(pulse)의 전류를 일회 혹은 반복적으로 가하는 형태로 이루어진다. 펄스는 일정시간 전류가 흐르는 단상(monophasic) 혹은 일정시간 전류가 흐른 후 극성이 바뀐 전류가 다시 동일 시간 흐르는 이상(biphasic)으로 가할 수 있다. 이상 펄스는 전기자극시 전극과 조직 접점에서 발생하는 전기화학(electrochemical) 손상을 줄일 수 있다[8,9].
펄스의 형태는 직사각형(rectuangular), 사인형(sinusoidal), 지수형(exponential) 등이 있다(Fig. 1). 신경조직의 흥분과 더불어 전기에 의한 흥분독성(excitotoxic) 신경조직 손상을 결정하는데 주요한 인자는 전하(charge, Q)와 전하밀도(charge density, QD)이다[10]. 전하는 사각형 펄스의 경우, 단위시간당 전하인 전류(단위는 mA)에 펄스 지속시간(단위는 ms)을 곱하여 구할 수 있으며, 단위는 microcoulombos per phase (μC/ph)이다: Q = I × D. 전극과 접한 부위의 전하밀도는 전하를 전극면적(A)으로 나눈 값이며 단위는, μC/cm2·ph이다: QD = Q/A.
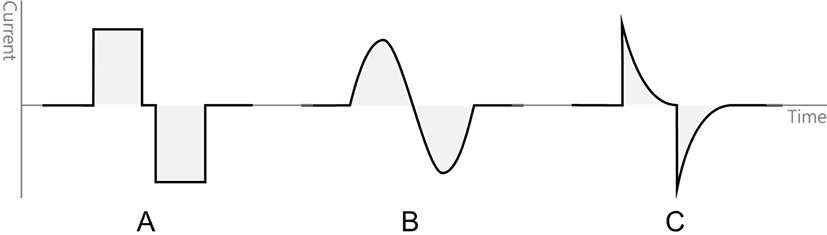
전기자극에서 축삭을 탈분극시키기 위한 전류의 양은 신경의 여러 특성에 영향을 받기는 하나, 주로 신경의 지름에 따라 달라진다. 일반적으로 지름이 작은 신경이 지름이 큰 신경보다 역치가 높아 더 큰 전류를 필요로 한다. 전술한 바와 같이 전하는 전류의 세기와 전류의 지속시간에 비례하므로, 탈분극을 일으키기 위해 필요한 전류의 세기와 펄스의 지속시간은 반비례한다고 볼 수 있다. 그러나 흥분성 조직을 탈분극시키기 위한 전기자극에서는 이러한 반비례 관계가 선형적이지 않다. 펄스의 지속시간이 아주 짧거나 긴 경우 더 많은 전하가 필요하다. 신경계의 자극에는 0.1ms 내지 0.3 ms의 지속시간이 가장 효과적이다. 체성감각유발전위 감시를 위해서는 0.2mg 내지 0.3 mg의 지속시간이 권고된다[11,12]. 하나의 신경에는 보통 여러 종류의 축삭들이 모여 있기 때문에 모든 종류의 축삭들을 탈분극시키기 위해 최대초과(supramaximal)의 전류를 가한다[11,12].
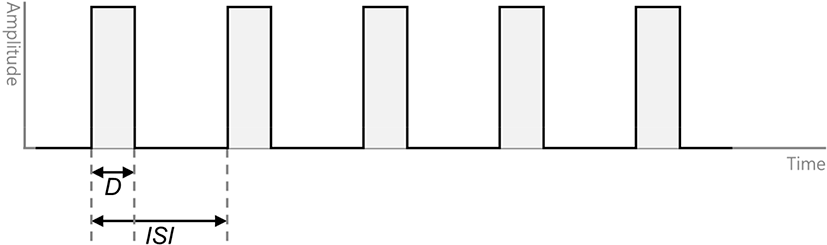
말초신경을 자극할 때에는 통상 한 번의 펄스 자극으로 충분한 탈분극을 일으킬 수 있으나, 운동유발전위를 위한 자극에서는 단일 자극보다 일련의 펄스(train of pulse)가 효과적이다. 일련의 펄스는 진폭(amplitude, 전압일 수도 있고 전류일 수도 있다)과 펄스지속시간 외에 펄스 횟수와 자극간 간격(interstimulus interval, ISI)으로 특정할 수 있다(Fig. 2). 자극간 간격 대신 빈도(frequency, Hz)로 표현하기도 한다: Frequency = 1/ISI. 운동유발전위감시에서 최적의 펄스 횟수와 자극간 간격은 표준화되어 있지 않기에 검사자의 환경에 따른 최적화가 요구된다[13–15].
전기에너지에 의한 조직 손상에는 전기에 의한 흥분독성 손상, 전극과 조직 접점에서의 열손상, 그리고 전기화학손상이 있다. 신경손상의 주된 기전은 흥분독성이다[10,16,17]. 흥분독성에 의한 신경손상에 가장 중요한 인자는 전달된 전하의 양과 전하밀도인데, 이 둘은 역으로 작용하여, 전하가 높아도 전하밀도가 낮으면 손상을 일으키지 않을 수 있고, 반대로 전하가 낮아도 전하밀도가 과도하게 높으면 손상을 일으킬 수 있다[9,10]. 피부를 통한 말초신경이나 뇌신경 자극을 위해 임상적으로 사용되는 전기자극에서 이러한 손상은 무시할 수 있는 수준이다. 그러나 비교적 높은 에너지를 사용하는 경두개 전기자극에서는 우려가 있다. 동물을 대상으로 수 시간 동안 지속적으로 전기자극을 반복적으로 가한 연구에 따르면 뇌손상을 일으킬 수 있는 전하와 전하밀도는 0.4 μC/ph와 40 μC/cm2·ph, 6 μC/ph와 12 μC/cm2·ph 등으로 보고되었다[10, 17]. 인체에 부착된 전극의 임피던스는 전류의 주파수에 따라 다르나, 통상 500 내지 1,500 ohm이다[18]. 임피던스를 1,000 ohm으로 가정할 경우, 진폭 500 V, 펄스 지속시간 0.05 ms, 펄스 횟수 3회로 경두개 전기자극을 가하면 펄스당 전하는 다음과 같이 계산할 수 있다: Q = I × D = D (1,000·V/R) = 0.05 (1,000·500/1,000) = 25 μC/ph. 전극 면적을 0.64 cm2로 가정할 경우, 전하밀도는 39 μC/cm2·ph이다. 그러나 경두개 전기자극시 두피와 두개골에 의한 전류의 션트와 분산으로 인해 피질에서의 전압은 두피의 약 20분의 1, 전하밀도는 약 30분의 1로 줄어든다[19]. 따라서 피질에서의 전하와 전하밀도는 동물 실험 결과에서의 손상 역치보다 낮다. 또한 동물실험이 7시간에서 15시간 동안의 긴 기간동안 반복자극을 준 것을 고려하면 매우 짧은 시간 자극을 가하는 경두개 전기자극에서의 총전하(전하와 펄스 수의 곱) 및 총전하밀도(전하밀도와 펄스 수의 곱)는 월등히 낮다.
전기자극으로 인한 열손상의 주요한 인자는 전기 에너지이다. 열손상을 방지하기 위해서 유발전위기기의 전기자극기는 International Electrotechnical Commission (IEC)의 국제표준에 따라 1,000 ohm의 부하 저항에서 펄스당 50 mJ을 초과해서는 안 된다[20]. 부하 저항을 1,000 ohm으로 가정하면 0.05 ms의 단상 직사각형 펄스를 1회 가할 때 최대로 가할 수 있는 전압은 아래와 같은 계산으로 구할 수 있다.
전기화학손상은 전극과 조직의 접점에서 발생하므로 직접전기자극에서 문제가 될 수 있다. 전류에 의한 전기화학반응은 조직내 pH 변화, 유기산화, 세포내 및 세포외 이온 변화를 통해 신경 손상을 유발할 수 있다[21]. 펄스 지속시간이 1 ms를 초과할 경우나 장시간 단상 펄스를 반복할 경우에 발생할 수 있다. 전기화학손상을 방지하기 위해서는 펄스 지속시간을 1 ms 이하로 하여야 하며, 수 초 이상 장시간 자극을 반복할 경우 이상 펄스를 사용하여야 한다[8,9,22].
임상신경생리학 검사에서 전기활동의 기록은 전위의 차이를 기록하는 것이다. 전위의 차이, 즉 전압을 기록하기 위해서는 기준점이 필요하다. 통상적인 전기회로에서 전압측정의 기준점은 땅이며, 땅으로 연결된 전극을 접지(ground) 전극이라 한다. 젖은 흙을 함유한 땅은 풍부한 자유전자를 가지고 있어 전하가 고여 있지 않고 바로 퍼져 흐르기에 전위의 차가 거의 없다. 마치 고도를 측정할 때 해수면을 기준으로 하듯 우리는 땅의 전위를 0 V로 가정한다. 접지는 전압 측정의 기준점으로 활용되는 동시에, 불필요하게 생성된 전류를 흘려보내는 역할도 한다. 건물의 피뢰침이 접지 전극에 연결되어 있는 것이 그 예이다.
임상신경생리학검사에서는 미세한 신경계의 전위차를 차동증폭기(differential amplifier)로 기록한다[23]. 증폭기는 트랜지스터를 통해 작은 전압을 더 큰 전압으로 증폭한다. 트랜지스터의 베이스(base)에 작은 전류를 흘려보내면 더 큰 전위차를 가지는 에미터(emitter)와 컬렉터(collector) 사이의 전류가 베이스의 전류에 비례하여 흐르는 것이 증폭의 원리이다. 차동증폭기는 두 개의 입력을 각각 상반된 극성의 전력이 연결된 두 개의 증폭기로 증폭한 후, 이를 서로 연결하여 두 전극 간의 전위차를 얻는다[24]. 두 입력은 흔히 활성(active)과 기준(reference) 입력으로 불리나, 실제 두 입력의 전기적 처리는 동일하다.
차동증폭기 사용의 주된 이유는 만약 인접한 두 지점간의 전위차만을 기록한다면 전력선에 의한 강한 전자기장과 같이 두 지점 전체에 영향을 줄 수 있는 큰 범위의 잡음(noise)을 제거할 수 있기 때문이다. 이와 같이 두 전극에 동시에 작용할 만큼 큰 노이즈를 공통모드잡음(common mode noise)이라 한다. 이상적인 차동증폭기는 공통모드잡음을 서로 상쇄하여 완전히 없애야 하지만, 실제로는 그렇지 않다. 차동증폭기 내의 두 트랜지스터의 속성이 완전히 일치하지 않을 수 있으며, 두 전극의 임피던스가 완전히 일치할 수 없기 때문이기도 하다. 차동증폭기가 공통모드잡음을 상쇄시키는 능력은 공통모드신호제거율(common mode rejection ratio, CMRR)로 수치화할 수 있다[25]. 차동증폭기의 두 입력에 10 μV의 전위차를 주었을 때 출력되는 신호가 10,000 μV라면 차동이득(differential gain)은 1,000이다. 차등증폭기의 두 입력에 10 μV의 공통모드신호를 주었을 때 차동증폭기에서 출력되는 신호가 10 μV라면 공통모드이득(common mode gain)은 1이다. 이 경우 CMRR은 다음과 같다: CMRR = 20 × log10 (differential gain/common mode gain) = 20 × log10 (1,000/1) = 60 dB. 증폭기 자체의 CMRR이 높더라도 전극 자체의 임피던스가 높거나 전극들간의 임피던스 차이가 크다면 CMRR이 크게 낮아질 수 있다.
차동증폭기가 두 전극 간의 전위차를 기록하기는 하나, 차동증폭기의 각각의 입력에서 받아들이는 전위는 공통기준(common reference) 전위 혹은 접지전위를 기준으로 한다. 과거에는 환자의 접지 전극이 실제 땅으로 연결되는 접지 전극(모든 건물에는 땅 깊숙한 곳까지 박아넣은 금속물체로 연결되는 접지가 있다)과 연결되기도 하였다. 그러나 이는 매우 위험한 일이다. 의도치 않게 인체 가까이 혹은 인체와 부착된 도체에 큰 전위가 발생한다면 인체가 이 전위를 접지로 흐르게 하는 통로 역할을 하기 때문이다. 현재는 안전기준에 따라 인체에 부착되는 접지가 실제(땅과 연결되는) 접지와 연결되어서는 안 된다. 현재의 신경생리검사에서 접지 전극의 주된 역할은 공통모드잡음을 제거하는 것이다. 차동증폭기에 연결된 두 전극은 서로 인체라는 도체로 연결되어 하나의 고리(loop)를 형성한다[26]. 도체로 이루어진 고리는 안테나의 기본적인 형태이다. 차동증폭기에서부터 두 전극과 인체로 형성된 안테나는 주위의 자기장에서 전류를 유도한다. 휴대전화 신호, 텔레비전이나 라디오 신호 등이 모두 이 안테나에 영향을 줄 수 있지만, 이들은 임상신경생리검사에서 사용하는 주파수대역보다 훨씬 높은 주파수여서 검사를 방해하는 일은 거의 없다. 그러나 우리 주변에 산재한 220 V 전력선들은 모두 60 Hz 전자기파 송출기로 작용하며, 안테나는 이 신호를 효율적으로 받아들인다. 접지 전극은 이 안테나를 통해 인체로 유입된 전류가 빠져나갈 수 있는 통로로 작용하여 공통모드잡음을 감소시킨다.
검사 시행의 실무적인 관점에서 공통모드잡음에 큰 영향을 주는 것은 첫째로 전극의 임피던스이다[27]. 공통모드잡음이 기록되는 정도는 두 전극의 임피던스의 차이에 비례하고, 증폭기 임피던스에 반비례한다(현재의 임상신경생리검사 장비들은 증폭기 임피던스를 가능한한 높게 만든다). 이상적으로는 활성 전극과 기준 전극의 임피던스가 동일하여야 하지만, 실제 검사에 사용되는 전극들의 임피던스를 동일하게 한다는 것은 거의 불가능하다. 전극 간 임피던스의 차이를 줄이기 위해서는 전극의 임피던스를 가능한 낮추어야 한다. 두 전극의 임피던스가 각각 6,000 ohm과 4,000 ohm일 때보다는 600 ohm과 400 ohm일 때 전극 간 임피던스의 차이가 작다. 두 번째는 전극 간의 거리이다. 전극이 떨어져 있을수록 영향을 받는 공통모드잡음에 전위차가 나타날 가능성이 높아진다. 세 번째는 전극을 증폭기에 연결하는 전선이다. 전선이 길고 서로 멀리 떨어져 있을수록 공통모드잡음의 영향이 커진다. 한 쌍의 입력 전선을 서로 꼬아 배열하는 것도 전자기장의 영향을 줄일 수 있는 방법이다.
신경과 같은 흥분성 조직은 휴지기에 세포 내가 음전위를 띄는 분극화(polarized) 상태이다. 일정 역치 이상으로 탈분극이 일어나면 전압개폐소디움통로(voltage-gated Na+ channel)를 통해 세포내로 소디움이온(Na+)이 급격히 유입되면서 활동전위(action potential)가 형성된다. 형성된 활동전위는 인접한 신경분절의 탈분극을 유발하여 순차적으로 활동전위가 전파된다. 탈분극된, 즉 세포내 전위가 비교적 양전위를 띄는 분절과, 아직 분극상태로 세포내 전위가 비교적 음전위를 띄는 인접한 분절은 이동하는 쌍극자(dipole)의 형태를 취한다(Fig. 3). 동시에 탈분극된 분절 주위의 세포외 조직은 비교적 음전위를 띄고, 인접한 부위는 양전위를 띄어 역시 이동하는 쌍극자를 형성한다. 활동전위는 한 번 발생하면 축삭 말단까지 전파된다(all-or-none). 전파된 활동전위는 축삭말단에서 연접(synapse) 내로 신경전달물질을 유리하고, 이 신경전달물질에 의해 연접후 세포의 수용체가 활성화되면 주위 막전위의 변화, 즉 연접전위(synaptic potential)가 형성된다. 연접전위는 흥분성(탈분극성)일 수도 있고, 억제성(과분극성)일 수도 있다. 연접전위는 국소전위로, 신경원을 따라 수동적으로 전파되며, 활동전위를 일으키지 못한다면 멀리 전파되지 못한다. 여느 신경생리검사와 마찬가지로 수술중 신경생리감시에서 기록하는 전기활동은 활동전위와 연접전위에서 기원한다. 전위의 기록은 원점(source)과 기록 전극의 거리에 따라 (1) 단위 또는 다단위 전위(unit or multiunit potential), (2) 근접부위 전위(near-field potential), (3) 원부위 전위(far-field potential)의 세 범주로 나눌 수 있다[28].
단위 전위는 하나의 신경섬유나 신경세포에서 기록되는 방전을 의미하며, 다단위 전위는 복수의 소규모 신경섬유들 혹은 신경세포들에서 기록되는 방전을 의미한다. 단위 전위는 미세전극을 신경섬유나 세포에 직접 접촉시키거나 근접시키는 방법으로 기록할 수 있다. 수술중 신경생리감시에서 단위 또는 다단위 전위 활용의 대표적인 예는 뇌심부 자극을 위한 전극 삽입술이다. 뇌심부 자극을 위한 전극 삽입의 목표 지점을 명확히 하기 위해 미세전극을 삽입하고, 전극의 위치를 국소화하는 미세전극기록(microelectrode recording, MER)을 시행한다. 기록을 위한 전극은 2–3 μm 크기(microelectrode)로 단위 전위를 측정하거나 약 50 μm 크기(semi-microelectrode)로 다단위 전위를 기록한다[29]. 뇌영상으로 목표 구조물의 좌표를 구한 후 정위수술을 통해 해당 부위에 미세전극을 삽입하고, 자발활동, 수동운동이나 감각 등 생리적 자극에 대한 반응, 전기 자극에 대한 반응에 따른 활동을 기록 및 분석하여 전극이 위치한 부위를 추정한다. 단위전위와 다단위전위는 다발적으로 나타나는 극파들이며, 개개의 극파는 모두 단일 세포에서 발화한 활동전위다. 활동전위는 “all-or-none” 특성 때문에 거의 동일한 모양과 진폭을 가져 다른 전위에 의한 파형들과 구분된다. 활동전위의 파형이 일정하기 때문에 MER에서는 활동전위의 발화 빈도나 발화간 간격, 발화 반복의 형태, 그리고 자극에 따른 변화가 해석에 중요한 인자이다[30].
근접부위 전위는 신경이나 섬유다발, 신경핵, 피질 등 특정 신경계 구조물에 인접한 전극에서 기록되는 전위이다. 다수의 신경 섬유나 세포들의 활동을 반영하지만, 하나의 구조물에 의한 것으로 간주할 수 있다. 다수의 활동 전위의 합이기에 복합활동전위(compound action potentials)라 부른다.
신경에서 측정되는 근접부위 전위는 축삭을 따라 이동하는 활동 전위를 반영한다. 축삭에서 활동 전위가 이동하는 속도는 축삭의 지름에 비례하는데, 대체로 4.5 cm/ms/μm로 알려져있다[31]. 일반적으로 말초 감각 및 운동 신경의 전도 속도는 4 cm/ms 내지 6 cm/ms이다[28].
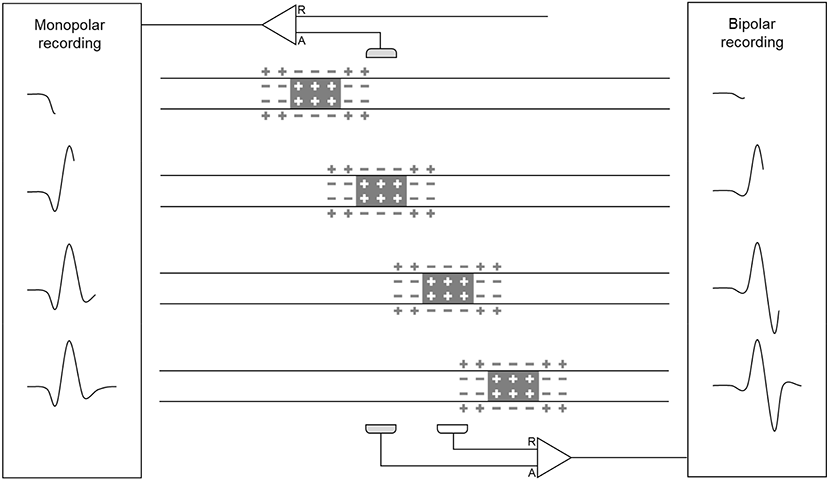
신경에서 일정 거리만큼 떨어진 곳에 자극을 주어 탈분극을 일으킨 후 단극(monopolar) 전극으로 복합활동전위의 이동을 기록하면 첫번째로 작은 양편위(positive deflection)를 보인 후 강한 음편위가 뒤따르고, 뒤이어 작은 양편위신경이 나타나는 삼상(triphasic) 형태를 볼 수 있다(Fig. 3). 탈분극이 이동함에 따라 이동하는 탈분극 바로 앞뒤로 쌍극자가 형성되는데, 선행하는 쌍극자에 의해 양편위가 나타나며, 탈분극 부위가 전극 바로 아래 부위를 지나는 시점에서 강한 음편위가 나타나고, 뒤이어 탈분극을 뒤따르는 쌍극자의 양전위에 의해 양편위가 나타난다.
같은 복합활동전위를 신경경로를 따라 가까이 배치한 한 쌍의 두 극 전극으로 기록하면 단극 전위 기록과는 다른 파형을 얻는다. 단극 전극 기록은 바로 아래 신경을 따라 지나가는 탈분극뿐만 아니라, 좀 더 원위부에서 수동적으로 퍼져온 전위도 기록될 수 있지만, 두 극 전극으로 기록할 경우 원위부에서 수동적으로 퍼져온 전위는 서로 가까이 위치한 전극들에 의해 상쇄된다. 이로 인해 자극 부위에 가까운 전극을 향해 탈분극이 다가올 때 단극 기록의 삼상파에서 보이던 양편위는 미미해진다. 탈분극 부위가 첫 번째 전극에 도달하면 강한 음편위가 나타나며, 탈분극 부위가 자극 부위에서 먼 두 번째 전극에 도달하면 강한 양편위가 나타나는 이상파가 형성된다(Fig. 3).
자극 시점부터 삼상파의 음편위 정점까지의 시간이 탈분극이 자극 지점에서부터 단극 전극의 위치까지 오는데에 걸리는 시간이다. 음편위의 지속시간은 탈분극된 부위의 크기가 클수록, 그리고 탈분극의 이동속도가 느릴수록 길다. 음편위의 형태는 탈분극을 전달하는 축삭들의 다양한 전도 속도와 탈분극이 시작된 부위와 전극 간의 거리를 반영한다. 만약 해당 신경에 전도속도가 다른 여러 신경섬유들이 있다면 이들 그룹 간의 음편위의 정점은 먼 거리를 이동하면서 점차 분리되어 삼상파와는 다른 형태를 띌 수 있다. 이를 생리적(physiologic) 시간분산(temporal dispersion)이라 하며, 각각의 축삭의 지름과 자극-기록 간의 거리의 영향을 받는다. 생리적 시간분산은 운동신경보다는 다양한 직경의 축삭이 혼재된 감각신경에서 두드러진다[32].
근육에서 측정되는 근접부위 전위는 근수축에 의해 나타나는 복합근육활동전위(compound muscle action potential)이다. 운동단위(motor unit)는 하나의 척수운동신경원(spinal motor neuron), 이에서 기원하는 축삭과 운동종말판(motor endplate), 그리고 이를 공유하는 근섬유들로 이루어진다. 하나의 운동단위는 몇 개에서 100개 이상의 근섬유를 포함한다. 운동단위에 의해 형성되는 전위를 운동단위활동전위(motor unit action potential)라 하며, 이는 통상 바늘근전도로 기록할 수 있다. 피부나 피하 전극을 이용해 측정하는 복합근육활동전위는 여러 운동단위활동전위의 합이다.
운동신경을 통해 전달된 전기 신호는 운동종말판 부위에 위치한 운동신경 끝단에서 아세틸콜린(acetylcholine)을 유리하고, 아세틸콜린이 운동종말판의 수용체와 결합하여 운동단위에 근수축 신호를 전달한다. 마취에 흔히 사용되는 근신경차단제(neuromuscular blocker)는 두 종류로 나뉘는데, 비탈분극성(non-depolarizing) 근신경차단제[큐라레유사(curariform)라고도 불린다]는 아세틸콜린이 운동종말판의 수용체와 결합하는 것을 막아 신호 전달을 차단하여 근섬유의 수축을 막는다. 탈분극성 근신경차단제[석시닐콜린(succinylcholine)이 대표적이다]는 운동종말판을 탈분극시켜 더 이상 근섬유가 반응하지 않도록 한다. 두 가지 모두 복합근육활동전위의 형성을 효율적으로 억제할 수 있다.
복합근육활동전위의 이상적인 기록을 위해서는 활성 전극을 운동종말판이 위치하는 부위에 부착하고, 기준 전극을 좀 더 원위부에 부착한다. 하나의 운동신경 혹은 감각운동신경에 최대초과 전기자극을 가하면 해당 근육 전체가 활성화되는데, 이상적으로 전극을 부착하였다면 복합근육활동전위는 음-양의 이상파로 나타난다. 이는 활성 전극에 인접한 부위에서 근육활동전위가 발생하여 먼 곳으로 퍼져나감을 의미한다. 만약 전극이 활성화된 근육에서 떨어진 곳에 부착되었다면 복합근육활동전위는 양-음의 이상파로 나타나며, 이는 전위가 전극을 향해 다가오기는 하나, 전극이 부착된 위치까지 이르지 못하였음을 의미한다.
경두개전기자극에 의해 유발되는 복합근육활동전위는 말초신경의 자극에 의해 유발되는 전위와는 달리 다상(polyphasic) 형태이며, 진폭도 작다. 경두개 전기자극에 의한 신호가 근육까지 전달되는 과정에서 비동기화(desynchronization)가 일어나고, 이에 의해 시간적으로 분산된 복합근육활동전위가 서로 위상상쇄(phase cancellation)를 일으키기 때문으로 보인다[33]. 또한, 동일한 환자에서 동일한 조건으로 자극을 반복해도 파형과 진폭의 계속 변화하는데, 이는 현재의 경두개 전기자극 기법이 척수운동신경원 중 일부만을 활성화시킨다는 것을 시사한다[34].
원부위 전위란 신경이나 핵 등 전위 발생 부위에서 먼 곳에 위치한 전극에서 측정되는 전위이다. 원부위 전위는 여러 부위에서 발생하는 전위들이 복합될 수 있으며, 근접범위 전위에 비해 그 크기가 작고 모양도 불규칙하다. 원부위 전위의 원점을 추정하기 위한 이론적 배경은 각각의 신경학적 구조들은 각각 독립된 원점으로서 쌍극자처럼 작용한다는 것이다. 원부위 전위는 여러 쌍극자들 각각의 강도와 3차원적 배열, 기록 전극과의 거리, 그리고 전기 매개체의 특성 등 다양한 영향을 받기 때문에 그 근원을 추정하기 쉽지 않은 경우가 많다.
원부위 전위에서 측정되는 원점을 두 가지로 구분할 수 있는데, 첫 번째는 신경핵 등과 같이 고정된 구조물에서 기원하는 정지한(stationary) 원점이다. 체성감각전위에서 뇌간핵에 의해 형성되는 N18이 그 예이다. 두 번째는 신경 축삭을 따라 전도되는 전위와 같이 움직이는(traveling) 전위가 특정 지점에서 정지된 정점(stationary peak)을 형성하는 것이다.
움직이는 전위가 특정 지점에서 정지된 정점을 형성하는 대표적인 경우는 전위가 서로 다른 용적전도체(volume conductor)의 경계를 지나갈 때이다(Fig. 4). Nakanishi는 황소개구리의 좌골-비골 신경(sciatic-tibial nerve)을 적출하여 링거액(Ringer’s solution)이 든 플라스틱 상자에 넣고 신경의 경로를 따라 격벽을 장치하여 8개의 구획으로 나누었다[35]. 근위부 두 개의 구획에서 전기 자극을 가하고, 나머지 6개의 구획에서 다양한 조합으로 복합활동전위를 측정하였는데, 인접한 두 구획의 전극으로 측정한 기록에서는 해당 구획을 지나가는 복합활동전위에 의한 이상(biphasic)파가 기록되었지만, 서로 떨어진 구획에서 측정한 기록에서는 두 전극 사이에 위치한 구획의 수와 같은 개수의 추가적인 전위가 기록되었다. 신경을 통해 전파되는 전위가 분리된 구획의 경계를 지날 때마다 추가적인 정지된 정점을 형성한 것이다. Kimura 등은 사람을 대상으로 요골 경상돌기(styloid process of radius)의 원위부 10 cm 지점에서 요골신경(radial nerve)에 전기자극을 가하여 형성된 복합활동전위를 측정하였다[36]. 기록 전극은 요골신경 경로를 따라 1.5 cm 간격으로 부착하였고, 추가로 새끼손가락 근위부에 기준 전극을 부착하였다. Nakanishi의 동물 실험과 마찬가지로, 요골신경 경로를 따라 설치된 전극으로 두 극 기록을 하면 해당 위치를 지나가는 복합활동전위만이 기록되지만, 새끼손가락의 전극을 기준 전극으로 하는 단극 기록에서는 전극 위치와 무관하게 일정한 잠복기에 형성되는 두 개의 전위가 기록되었다. 이 전위들은 각각 손가락 기저부와 손목부위에서 형성된 복합활동전위의 잠복기와 같으며, 각각 손가락 기저부 및 손목부위의 원위부 전극에서 기록되었다. 즉, 용적전도체가 변하는 손목과 손가락 기저부에서 형성된 것이다.
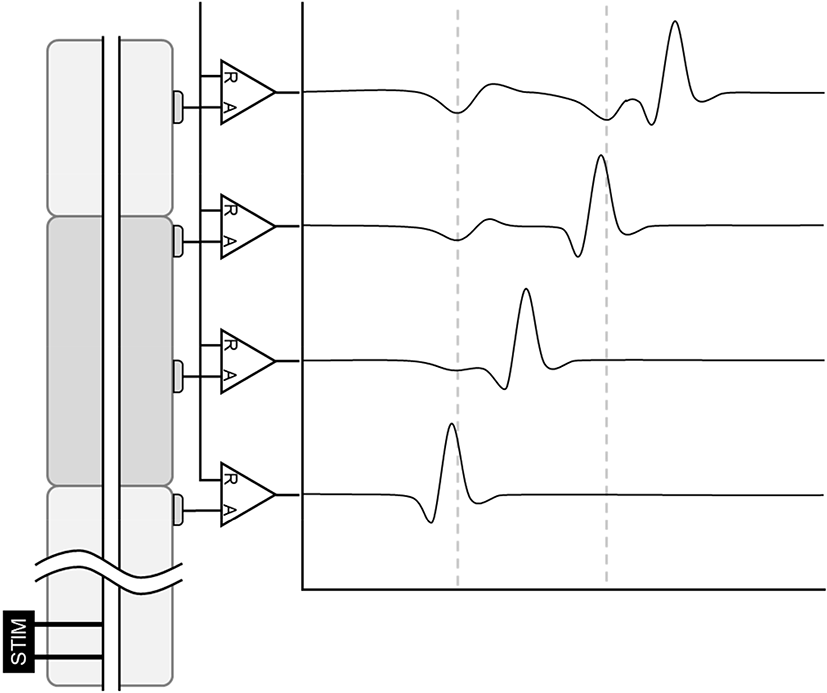
움직이는 전위가 정지된 정점을 형성하는 다른 경우는 전위의 이동 방향이 급격하게 변할 때이다. 정중신경 체성감각유발전위를 이용한 연구에서, 팔목을 90°로 굽히고 기록하면 팔을 편 상태에서는 나타나지 않던 원부위 전위가 어깨봉우리뼈 부위의 단극 기록에서 나타난다[37]. 이 전위의 잠복기는 자극을 가한 팔에 부착된 일련의 전극들 중 팔목 부위 전극에서 기록된 복합활동전위의 잠복기와 일치하였다. 팔목에서 정중신경 경로가 90°로 변하면서 이 부위에서 원거리 전위가 형성된 것을 알 수 있다.
결론
수술중 신경생리감시를 위한 전기자극을 위해서는 전기의 기본적 성질과 자극의 특성에 따른 목표 신경조직의 전기생리학적 변화, 그리고 자극의 안전성에 대한 기본적 원리를 이해하여야 한다. 이에 대한 이해가 없다면 실제의 다양한 임상상황에 따라 최적화된 전기자극을 시도하지 못하고, 그저 처음 세팅한 자극만을 반복하게 되거나, 위험한 방식의 시도를 할 수 있다. 신경계 전기활동의 기록도 마찬가지로 전기기록의 기본적 원리를 이해하여 적합한 검사 방법을 확립하고, 복잡한 수술장 환경에서 실시간으로 발생하는 여러 기록상의 문제들에 대처하여야 한다. 마지막으로 수술중 신경생리감시 결과의 적절한 해석을 위해서는 신경계에서 생성되는 전위가 기록되는 방식에 대한 이해가 밑받침되어야 한다.







