서론
수술중신경생리감시(intraoperative neurophysiological monitoring, INM)는 수술 중 국소 또는 전반적 중추신경계의 혈류 공급 및 산소화를 반영하는 신경계 대사 상태를 평가하거나, 신경구조물의 전반적 기능 또는 세부 기능을 반영하는 신경기능 평가를 하는 것으로 다양한 유발전위(somatosensory evoked potentials, SSEP; motor evoked potentials, MEP; brainstem auditory evoked potentials, BAEP; visual evoked potentials, VEP), 근전도(electromyogram, EMG), 뇌파(electroencephalogram, EEG), 뇌혈류(transcranial Doppler, TCD) 등의 검사를 진행하면서 수술 진행 중 발생하는 기능적 변화를 감시하여 신경 손상 가능성을 조기 예측하게 된다.
INM 감시에 적절한 마취 기법은 신속한 작용, 쉬운 마취 심도 조절, 가역성이 보장된 약제이면서 다양한 신경 기능 감시 파형에 영향을 주지 않는 안전하고 효율적인 방법이어야 한다. 뇌혈류검사는 마취에 민감한 영향을 받지 않지만, 다른 전기생리학적 검사는 대부분 마취약제 및 근이완제의 영향을 받으며, 투여되는 약제의 종류와 농도에 따라, 사용하는 감시 기법 종류에 따라 파형 형성에 지대한 영향을 미칠 수 있다. 현재 대부분의 INM에서 가장 보편적으로 사용하는 마취 기법은 프로포폴(propofol)과 저용량의 마약성 진통제(opioid analgesics)를 이용한 완전정맥마취(total intravenous anesthesia, TIVA)이다. 여기에서는 전신마취제의 종류와 작용 기전을 소개하고, INM의 영향을 고찰하여 임상신경생리 전문가로서 마취 과정에 대한 지식을 기본으로, 수술 중 변화에 대해 집도의나 마취팀과 적절히 소통하는 능력에 도움을 주고자 한다.
본론
전신마취를 위해서는 무의식, 기억상실, 반사둔화, 무통, 근육마비 등 다양한 요소가 적절히 조절되어야 한다. 즉, 무의식상태에서 통증 없이 심한 수술 자극에 대한 근육 및 반사 반응이 억제된 상태가 유지되어야 하므로 근이완제, 진정제, 진통제 등 여러 약제가 동시에 사용된다. 고전적인 흡입마취제의 개발 외에 1980년대 빠른 발현과 짧은 작용시간을 갖는 새로운 마취 약물, 아편 유사제와 근이완제가 차례로 개발되면서 정맥마취가 발전하게 되었고, 지속정주 조절주입기(syringe pump)나 목표농도 조절 주입 펌프(target controlled infusion pump)와 같이 전 수술기간 동안 일정한 마취 유지를 위한 방법 개선, 근이완제의 잔류효과의 양적인 측정방법으로서 신경자극기(train-of-four ratio), bispectral index(BIS) 등의 마취 심도 감시 장비를 포함하여 전체적인 마취 기법이 개발되어 왔다.
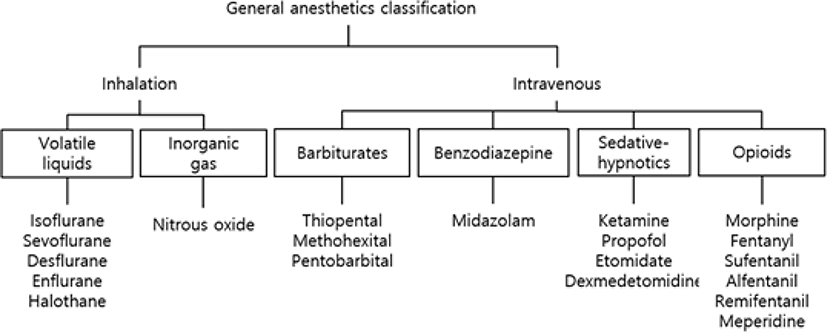
전신마취는 사용하는 약제의 투여 경로에 따라 2가지로 나눌 수 있다. 흡입마취제로 마취를 유도하고 유지하는 방법을 흡입마취(volatile induction and maintenance anesthesia, VIMA)라고 하며, 완전정맥마취(total intravenous anesthesia, TIVA)란 흡입마취제나 아산화질소를 사용하지 않고 정맥마취제만으로 마취의 유도와 유지하는 것을 말한다. 주 마취제 외 마취 보조를 위해 사용되는 약물도 있으며(Fig. 1), 각각 유발전위에 미치는 영향 또한 다르다[1–4] (Table 1). 공통적으로 축삭 전도보다는 시냅스 전도를 거치는 경우, 특히 다중시냅스연접(polysnaptic pathway)을 많이 거치는 INM 감시기법일수록, 짧은 잠복기의 유발전위보다는 긴 잠복기의 유발전위에서 신호 억제 영향이 크다. 마취약제의 뇌파에의 영향은 이 종설에서는 표로 간략히만 정리하였다(Table 2).
흡입마취제는 투여 및 배설이 폐를 통해서 이루어진다는 점과 마취 심도를 신속하게 변화시킬 수 있고, 즉시 농도를 측정할 수 있다는 것이 장점으로 고전적으로 사용되는 마취방법이다. 일반적으로 흡입마취제 효과를 나타내는 강도는 최소 폐포내 농도(minimum alveolar concentration, MAC)로 표현하는데, 이는 피부 절개 등 표준자극에서 50%의 환자가 움직이지 않을 때의 폐포 내 마취제의 농도를 말한다. 혈액-가스 분배 계수가 클수록 용해도가 크며 마취 유도가 지연된다. 억제성인 GABA 수용체와 glycine 수용체의 기능을 항진시키고, 흥분성인 nicotinic acetylcholine 수용체 및 glutamate 수용체 기능을 억제시키는 작용기전을 갖는다.
Halothane은 최초의 휘발성 fluorinated anesthetic이며, 할로탄의 20% 이상이 간에서 대사(trifluoroacetic acid 등)되는데, 대사체가 치명적인 간독성이 발생할 가능성이 낮게 남아 있고, enflurane은 신장에 대한 독성 및 부작용으로 사용 빈도가 감소하여 현재 대부분은 독성이 적은 desflurane, sevoflurane, isoflurane 등의 약물로 대체되었다. Isoflurane은 체내 흡수나 제거가 sevoflurane이나 desflurane보다 느려 최근 INM에는 잘 사용되지 않는다. Sevoflurane은 isoflurane에 비해 냄새가 덜 자극적이어서 기관지 자극이 적고 desflurane보다 강한 효력을 나타내며, 또한 혈액에 대한 용해성이 낮아(blood-gas coefficient 0.65) 마취로부터의 각성이 빨라 가장 흔히 사용되는 흡입마취제이다. Desflurane은 자극적인 냄새로 인해 흡입마취제를 통한 마취 유도로는 흔히 사용되지 않으나, 혈액에 대한 용해성(blood-gas coefficient 0.42)이 낮아, 흡입마취제 중 마취로부터의 회복이 가장 빠르다는 큰 장점을 가지고 있다. 흡입마취제는 SSEP보다 근육 MEP 억제 효과가 크다고 알려져 있는데, 이는 대뇌피질의 시냅스 전달 억제, 하부운동신경세포로의 연접에서의 흥분 억제, 신경근 접합부의 억제 등 여러 시냅스를 거치면서 마취약제의 영향을 많이 받기 때문이다. SSEP에의 영향 또한 용량 의존적으로 유발전위 잠복기 연장, 진폭 감소 효과를 보이며, 여러 번의 시냅스 연접과정을 거칠수록 신경억제 영향이 누적되므로 피질 전위 및 근위필드 전위(cortical SSEP, N20, P38, VEP)의 파형 형성에 영향이 크고, 피질하 체성감각유발전위(subcortical SSEP) 및 말초 감각유발전위, 짧은 잠복기의 유발전위 경우 마취에 영향을 덜 받는다. 흡입마취제는 전신마취에 필요한 흡입마취제 농도 1.0 MAC(minimum alveolar concentration, 최소 폐포내 농도) 이상을 유지하게 되면 수술중 신경생리감시가 원활하지 않으므로, 좋은 파형을 얻을 수 있는 정도의 흡입마취농도 MAC 0.5–0.7을 유지하는 것이 좋다[3,5,6]. 척수신경원 근위부의 경막외 전극에서 기록된 D파형 및 근신경접합부의 시냅스는 흡입마취제에 영향이 비교적 적어 MAC 0.5 이하, 다중펄스 경두개전기 자극을 사용하여 근육 MEP 및 D 파형을 얻을 수 있다. Desflurane 0.6–0.8 MAC 및 0.5 MAC을 이용하였을 때 propofol과 remifentanil 병용투여보다 근육 MEP 및 SSEP의 유의한 잠복기 연장 및 진폭을 유발하며, 최소한의 감시에 적절한 정도의 신경생리신호를 추적 감시할 수 있었다는 연구가 있다[7,8]. 그렇지만, 근육 MEP를 최적으로 감시하기 위한 가장 좋은 방법은 흡입마취를 피하는 것이다.
과거 전신마취에 있어 정맥 약물의 사용은 혈액내로 약물이 직접 주입되므로, 흡입마취에 비해 작용 발현시간이 빨라 전신 마취 유도(induction) 및 흡입마취의 보조용도로 이용되었다. 90년대 프로포폴의 개발과 컴퓨터화된 조절주입기의 개발 등 마취기술의 발달로 최근에는 단독 사용이 증가되어 왔다. 완전 정맥마취를 위해서는 몇 가지 약제를 동시에 투여하는데, 최면-진정제 및 진통제, 비탈분극성 신경근차단제가 기본이 된다. 마약성 진통제와 혼합 사용시 심혈관계 반사 억제, 향상된 진정작용, 수술 전후 진통 등의 효과를 추가적으로 기대할 수 있다. Benzodiazepine계는 상대적으로 barbiturate나 propofol에 비해 작용시간과 회복시간이 느리지만, 마취전 약제로 사용시 긴장완화나 기억상실, 진정상태를 유도하는데 사용할 수 있다. 완전정맥 마취를 위해서는 propofol이나 remifentanil 이외에도 midazolam, phentobarbital이나 다른 마약성 진통제 등 여러 정맥마취제를 조합하여 사용할 수 있다.
가장 널리 사용하는 정맥마취제로 GABAA 수용체를 자극함으로써 중추 억제성 신경전달을 촉진시키며, 진정, 수면, 항불안, 기억상실, 항구토, 항경련 효과가 있으며, 진통효과는 없다[9]. 높은 지질용해성으로 혈뇌장벽을 신속히 통과하며, 높은 간청소율로 인해 Barbiturate와 비슷한 정도로 마취 도입이 빠르게 이루어지고, 일회 주입 후 최초의 분포 반감기가 2–8분이므로 투여 중단시 신속하게 의식을 회복하는 장점이 있다. 마취유지가 오래 되면 투여 용량에 비례하여 호흡 저하와 심근억제 및 전신 혈관 확장과 같은 심혈관계 억제작용으로 무호흡과 혈압 저하를 일으킬 수 있다. 마취 유도와 유지에 모두 사용할 수 있어, 완전정맥마취의 기본으로 사용된다. SSEP 및 MEP에 용량의존적으로 진폭 감소를 유도하나, 잠복기에는 거의 영향이 없다. 지속 정주시 안정적이고 예측 가능한 혈장 농도 유지가 가능하여 INM을 위한 최적의 마취 방법으로 가장 많이 사용되고 있다.
Thiopental은 마취유도시 흔히 사용되는 barbiturate로 지질용해성이 매우 높은 약물로서 신속히 뇌에 확산되어 혈장과 뇌의 평형상태에 도달하기 때문에, 정맥으로 유도 용량을 주사하면 한번의 순환만으로도 30초 내에 마취가 유도되며, 투여 중단시 다른 조직으로 재분포, 간으로 대사되면서 각성도 빨리 진행된다. 용량에 따라 심장 및 호흡 중추를 억제한다. 뇌압과 뇌혈류를 증가시키지 않기 때문에 뇌부종이 있는 환자에서 장점으로 사용될 수 있으나 대뇌 대사와 산소 이용을 감소시키므로 대뇌 기능 저하를 일으키며, INM에 사용되는 생체신호의 변화에 영향이 커서 진폭 감소와 잠복기가 연장된다. 흡입마취제와 같이 피질 SSEP의 잠복기가 가장 영향을 받고, 피질하 및 말초 SSEP에의 영향은 미미하다.
Thiopental보다는 호흡, 순환계통억제 효과는 적은 편으로 공통적으로 최면, 진정, 기억상실, 항경련 작용 및 근육이완작용이 있다. Midazolam은 수용성의 benzodiazepine으로 정맥 내 투여나 근육주사가 가능하며, 그 작용시간이 다른 benzodiazepine에 비하여 짧아 정맥투여시 3–5분경 최대 효과가 나타나고, 2–4시간 정도의 빠른 반감기를 보여 마취 영역에서 많이 사용되고 있다. 일차적인 대사는 간에서 hydroxylation을 통하여 이루어지며, 주된 대사산물인 1–hydroxymidazolam은 약효가 미미한 것으로 알려져 있으나, 신장을 통해 배설되기 때문에 신기능이 저하된 환자에게서는 체내에 축적되어 진정작용을 부가시킬 수 있다. Benzodizepine 계열 또한 MEP 진폭을 감소시키나, thiopental의 억제 강도보다는 약하다. Midazolam 은 고용량에서 SSEP 잠복기 연장은 미미하나, 상당한 진폭 감소를 보인다.
Ketamine의 작용은 NMDA(N-methyl-D-aspartate) 수용체에 비경쟁적으로 결합하는 길항제로, 흥분성 신경전달을 억제하여 최면-진정제로서 중추 신경계를 억제한다. 또한 통증의 중추 감작을 막아 정맥 최면 진정제 중 유일하게 강력한 진통작용, 수술 후 통증 완화 효과가 있으며, 교감신경계통의 직접적 자극 효과에 의해 카테콜아민 분비가 증가되어 용량의존적인 심혈관계 자극 효과가 있다. 주입 후 2–4분부터 혈압상승 및 맥박수, 심박출량 증가, 기도 평활근을 이완시키므로 기도저항 감소의 효과가 있고, 10–20분이 지나면 정상화된다. 심혈관계 및 호흡기계 억제가 없으므로 제한성 심외막염이나 심장압전 등 심혈관계 기능 저하 환자나 쇼크 상태의 외상환자에서 마취 유도시 장점으로 사용될 수 있다. 다른 마취약제와 달리 ketamine은 SSEP 및 MEP의 진폭을 증가시킨다. 이러한 이유로 척수신경 손상으로 인해 수술 전 생체신호 형성이 약한 경우 INM에 유리하게 기준 진폭 파형을 증강시킬 수 있어 INM에 적절한 마취약제로 선택할 수 있다. 그러나 뇌혈류를 증가시키고, 뇌의 산소이용과 뇌압을 상승시키는 경향이 있고, 수술 후 환각 및 발작을 유발하기도 하여 뇌부종을 동반한 종양 수술, 고혈압이나 뇌혈관질환 병력, 정신질환병력에서는 사용을 조심해야 한다.
다른 마취제에 비해 유도용량에서 심혈관, 호흡 억제가 미미하여 심혈관계 기능에 제한이 있는 환자의 마취 유도에 적합하다. 빠른 작용시간, 최소에 가까운 혈압 저하와 심박동 변화를 보이며, 무호흡은 거의 발생하지 않는다. 진통작용은 없어 마약성 진통제와 함께 사용한다. 피질 SSEP 진폭을 증가시키며, barbituration, propofol과 비교시 MEP 억제는 미미한 편으로 유도용량에서 일시적인 MEP 진폭 감소를 보이나, 잠복기 연장에 변화는 없다. 기술된 모든 정맥마취제 중 유도 및 지속 정주 유지 용량에서 가장 MEP 감소 영향이 적다. 그러나 장기간 사용시 부신 기능 저하(adrenocortical suppression)를 야기시킨다는 우려가 있다.
아편 유사제는 중추신경계에 있는 opioid 수용체와 결합하여 작용을 나타내며, 작용제로는 morphine, meperidine, fentanyl, sufentanil, alfentanil, remifentanil 등이 있으며 길항제로는 naloxone이 있다. 수술중 적절한 진통, 진정효과를 낸다. 마취 유도 전 사용하면 기관내 삽관에 따른 혈압상승과 빈맥 등 자율신경계 반응을 예방할 수 있다. Propofol은 진통효과가 없는 진정제이므로 주 마취제로 단독 사용할 때 기관 삽관 및 통증을 수반하는 수술 자극에 대해 심혈관계 반응을 억제하지 못하므로 추가적 진통제의 병용이 반드시 필요하며, 흡입마취제나 ketamine 은 진통효과를 갖고 있지만, 전신마취에는 추가적 진통제를 사용하는 것이 바람직하다. 일반적으로 심혈관기능을 억제시키지 않는 편이나, 중등도의 말초혈관확장에 의해 혈압저하, 심박출량 저하가 일어나기도 하며, 과량시 서맥 및 호흡중추 억제, 경련을 유발할 수 있다. 작용시간에 따라 수술 후 구역, 구토 발생가능성을 높인다. 합성 아편 유사제인 fentanyl, alfentanil, sufentanil, remifentanil의 일반적 마취사용량에서의 유발전위에의 영향은 미미하여 SSEP 및 MEP 감시에 필수적이다. Fentanyl은 morphine보다 50–100배 강력하며, morphine과 달리 혈뇌장벽을 쉽게 통과하여 정맥 주사 후 3–5분 후 빠르게 최대효과가 나타난다. Remifentanil은 fentanyl의 4-anilidopiperidine 유도체인 u 수용체 작용제로서 역가는 fentanyl과 비슷하나, anfentanil 보다는 15–30배 높다. 작용발현시간이 1분 이내로 매우 빠르며, 투여 중단 후 작용지속시간 역시 3–10분으로 매우 짧아 “ultra-short acting opioid”로 마취 약제영역에서 획기적인 전환점이 되었다. Remifentanil을 제외한 기존의 아편 유사제는 장시간 투여를 하게 되면 말초조직에 축적이 되고 배설이 지연되는 단점이 있다. Remifentanil은 처음으로 개발된 esterase-대사 아편 유사제로서 비특이성 esterase에 의해서 조직과 혈장에서 신속히 대사되므로 사용기간이나 용량에 영향을 받지 않는 빠른 대사가 이루어지고, 신장 및 간 손상의 경우에도 대사가 영향을 받지 않는다. 즉, remifentanil은 장기간 마취를 하더라도 상황 민감성 반감기(context-sensitive half-life time, CSHT)가 약 4분 정도로 거의 일정하게 유지되기 때문에 빠른 효과 발현과 소실이 주된 장점이라 할 수 있다. 또한 remifentanil은 흡입마취제와 병용 시 단일 흡입마취제의 양을 60% 정도 감량할 수 있고, propofol의 경우에도 투여량을 40%–50% 정도 더 감량할 수 있게 하므로 주 마취제의 농도 의존적 INM의 악영향을 줄일 수 있다. 이러한 장점을 살려 현재 propofol과 병용하여 완전정맥마취에 가장 흔히 사용되고 있다[10].
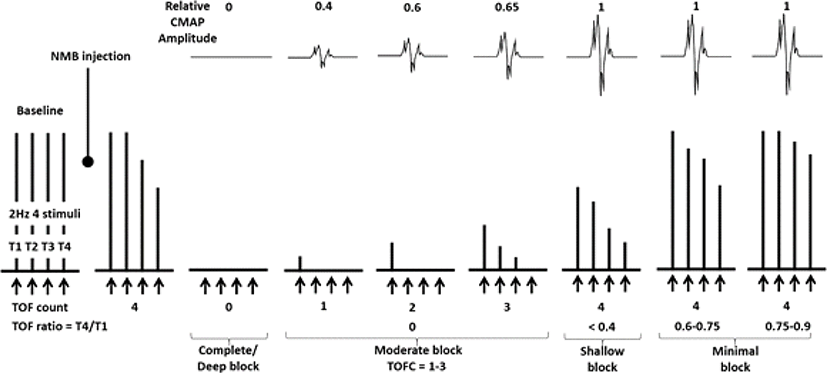
수술전 기관내관의 삽관(endotracheal tube insertion)을 용이하게 하며, 수술중 환자의 근강직을 억제하고 유연하게 하므로 수술 부위의 원활한 절개 및 수술시야를 확보하기 위해 사용한다. 비탈분극성 근이완제인 rocuronium, vecuronium, atracurium 등을 주로 사용하는데, 그 중 작용 발현이 더 빠르고(1–2분), 대사산물을 생성하지 않으면서 30–60분 정도의 작용지속시간을 갖는 rocuronium이 흔히 사용된다. 이런 신경근이완제는 INM에 사용하는 MEP 및 EMG의 신호를 감소시키거나, 심지어 없앨 수도 있으므로 복합근육활동전위(compound muscle action potential, CMAP)를 이용한 INM 기법을 이용하는 수술에서 신경근이완제는 사용을 최소화하여 기관 삽관 직전에 속효성 제제(short acting drug)를 1회만 사용하는 것을 권한다. 간헐적 반복 투여가 필요한 경우 투여 간격에 유의하고, 근이완제 작용의 감시에 각별한 주의를 기울여야 한다. 근육활동을 기록하지 않는 SSEP, BAEP 및 EEG에는 영향이 없으므로 지속정주 방법으로 속효성제제인 rocuronium(0.3–0.6 mg/kg/hr) 또는 cisatracurium(1–2 mcg/ kg/min)를 사용할 수도 있다. 신경근이완제의 체내 잔류는 사연속 자극(train–of-four, TOF) 검사를 통해 비교적 쉽게 알 수 있으므로 이를 사용할 것을 권고하며, 수술 중 사연속 반응(TOF count)이 적어도 2 이상 유지하거나, 사연속반응비(TOF ratio)가 0.7%–0.8% 정도 유지되어야 적정한 정도의 MEP 및 EMG 감시를 할 수 있다[11] (Fig. 2). TOF란 2 Hz로 연속 4회(0.5초) 최대상 자극(supramaximal stimulation)을 가하는 방법으로 이를 한 단위로 하여 10–15초마다 반복 자극할 수 있다. 비탈분극성 근이완제를 투여한 후 TOF 자극을 주면 첫번째에서 네번째로 갈수록 연축 반응이 작아지는 fade 현상이 나타나는데, 첫번째와 네번째 연축 반응 높이 비율(T4/T1)을 계산하여 근이완을 판정한다[12]. 만일 급하게 근이완제 효과를 되돌릴 필요가 있는 경우 신경근차단 역전제인 sugammadex를 이용하여 신경근차단 정도를 회복시키고, INM을 지속할 수 있다.
정맥마취 상태에서는 흡입마취와 달리 마취의 심도를 투약용량만으로는 예측하기 어려워 BIS(bispedal index)라는 장치를 통해 보조적으로 마취의 심도를 측정한다. 의식수준을 예측하기 위한 BIS index로 100은 완전각성상태, 0은 뇌의 활성도가 전혀 없는 상태를 반영한다[13]. BIS index 40 이하인 경우, 깊은 마취 상태로 MEP, SSEP 파형이 작게 관찰될 수 있으므로, INM을 하는 경우 50–60 정도로 유지하는 것을 추천한다 정맥 점적 투여(infusion)하는 방법은 시간당, 체중당 주입용량을 계산하여 주입하는 syringe pump가 대중적으로 사용되며, 현재는 환자의 성별, 나이, 키, 체중을 입력하고, 목표 혈중농도를 설정하면 약동표준모델에 의해 가상 혈중농도를 예측하여 자동으로 약물 주입 속도를 조절하는 목표농도 조절주입(target controller infusion, TCI) 방법도 사용된다.
대부분의 마취약제가 용량 의존적으로 시냅스 활동을 억제하여 유발전위를 감소시키므로[14–17] 적절한 INM 조합 방법을 계획함에 앞서 마취 약제를 선택해야 한다. 정맥마취로 진행을 해야만 IMN이 가능한 경우도 있고, 흡입마취로 진행을 해도 IMN을 할 수 있는 수술도 있다. 일반적으로 흡입제제는 정맥제제보다 유발전위를 억제하는 효과가 커 INM에 전적으로 사용하기 꺼려지지만 농도를 조절하기 쉽고, 안정적인 마취환경을 제공하는 장점이 있기 때문에, 0.5–0.8 MAC 정도의 낮은 농도의 흡입마취제 농도에서 SSEP나 BAEP 등 특정 유발전위 검사는 감시의 질이 저하되지 않는 적정한 수준에서 성공적으로 INM이 가능하다. 저용량의 흡입마취제와 저용량의 마약성 진통제 지속 정주(0.05 mcg/kg/min), propofol(50 mcg/kg/min) 또는 dexmedetomidine(0.003–0.005 mcg/kg/min)의 저용량 정맥마취제를 혼합한 균형마취 또한 INM이 가능하면서도, TIVA 사용시 드물게 발생하는 환자 움직임이나 각성을 감소시키고, 안정적인 마취를 제공할 수 있다. 정맥마취제도 대부분은 용량의존적으로 유발전위에 영향을 주며, 특히 midazolam을 비롯한 benzodiazepine 계열은 흡입마취제보다는 덜하지만 중등도로 유발전위를 억제시키므로 되도록 사용을 피해야 한다. 반대로 정맥마취제 중 etomidate, ketamine은 SSEP의 진폭을 증가시키는 경향이 있다. 그러므로 마취약제의 용량과 선택은 사용되는 INM 종류에 따라 맞춤 선택이 필요하다. 약제 별로 SSEP에 다른 효과를 나타내나. 일반적으로 피질유발전위, 긴잠복기의 유발 전위(e.g., VEP)가 마취약제에 민감하며, 짧은잠복기의 유발전위(e.g., BAEP), 말초 및 피질하 유발전위, 척수 D-파형의 경우 마취약제의 영향이 적다. 특히 BAEP는 마취의 영향을 거의 받지 않아서 흡입마취, 정맥마취 상관없이 잘 관찰된다. MEP, EMG를 이용하는 경우, 신경근차단제를 가능한 사용하지 않는 것이 유리하지만, 환자가 움직여서는 안 되는 미세수술을 하는 경우 비탈분극성 신경근차단제를 소량 사용하면서 TOF를 감시하는 것이 좋다. EMG만 감시하는 경우 근이완제의 사용만 매우 자제된다면 흡입마취로도 가능하므로 미세혈관감압술(microvascular decompression), 소뇌교각교(cerebropontine angle) 종양 제거 수술과 같이 BAEP 및 자발 근전도(spontaneous EMG) 및 유발 근전도(triggered EMG) 검사가 위주인 수술인 경우, 마취제 종류가 신경계 추적감시 검사에 크게 영향을 미치지 않는다. 정맥마취만을 시행해야 하는 수술은 척추 수술, 대뇌수술, 대동맥류 혈관 수술 중 운동기능을 평가하는 MEP를 이용하는 경우이다. MEP를 이용한 INM에 있어서는 정맥마취를 이용한 마취기법이 기존의 흡입마취제제를 이용한 마취기법에 비해 MEP의 생성률과 파형의 크기에 있어 탁월하게 우월한 것으로 알려져 있다. 그럼에도 불구하고 TIVA를 이용한 마취에서도 정맥마취제의 농도가 지나치게 높을 경우에는 MEP형성을 저해하고, 유발전위 파형 크기를 감소시킬 수 있음을 유의해야 한다.
INM을 하는 수술의 경우, 신경생리기능에 영향을 덜 미치는 마취제를 선택해야 하며, 마취유도가 된 이후부터 마취유지단계로 전환되는 시점이 빠를수록 본 수술이 시작되기 전 추적감시를 위한 기준파형을 설정하는데 유리하므로, 마취 유도시 일회성 투여(bolus injection) 용량을 최소화하고, 마취 심도가 얕아진 채로 마취 유지를 할 때에는 환자마다 약물 효과의 개인차가 있으므로 INM에 영향을 주지 않는 범위에서 마취수준을 일정하게 유지해야 한다. 특히 수술의 중요한 시기에는 근이완제 사용을 자제해야 한다. 일회성의 신경근차단제를 사용하는 경우에는 수술 중 움직임을 줄일 수는 있으나, MEP, EMG 해석에 혼동을 줄 수 있으므로, 신경근차단을 할 때에는 지속정맥주입을 사용해야 한다. 뇌동맥류 결찰, 척수 종양 제거, 척추수술 중 correction, 불안정 경추환자의 positioning 등 집중감시가 필요한 특정 시기에는 마취제나 근이완제 용량 변경을 하지 않아야 한다. 수술중 EEG에서 빠른 파형의 증가는 낮은 마취농도, barbiturate나 benzodiazepine 약제와 관련이 있다. MEP와 EMG 파형이 사라지면 신경근차단제나 benzodiazepine 사용 여부를 확인하고, TOF 자극반응으로 근이완 잔여 효과를 평가한다.
마취약제에 의한 감시 파형의 변화 외에도 체온, 뇌압, 실혈로 인한 빈혈 또한 전반적 신경 기능을 변화시키므로 유발전위에 중요한 영향을 미친다. 체온은 35℃ 이하면 EEG감시에서 점진적인 서파 증가 및 진폭 감소를 보이며, SSEP 감시에서는 중심 체온 1℃ 감소에 진폭의 7%, 잠복기의 3%가 증가된다. 동절기 장시간의 수술로 인한 중심 체온의 변화, 유발전위의 형성 경로에 차가운 생리식염수를 지속적으로 세척하는 경우 점진적인 유발전위 변화를 일으킬 수 있다. 혈압 감소 시 EEG에서 서파의 증가 및 진폭 감소를 보이며, 평균동맥압이 60 mmHg 이하로 유지되면 SSEP 파형이 소실된다[17] (Table 3).
결론
마취방법의 선택을 위해 영향을 미치는 주요 요인으로 환자 상태, 감시해야 할 신경계구조물 및 경로, 마취과 의사의 경험과 기술, 집도의의 선호도 등을 들 수 있으며, 적절한 INM을 단독 또는 여러 종류로 조합하여 사용하게 되므로 신경 감시에 방해되지 않는 최적의 마취 방법을 선택하여야 한다. Propofol이 임상에 도입되면서 TIVA가 가능해졌고, 많은 장점으로 인해 INM의 기본 마취 방법이 되었다. 환자의 활력징후 및 마취 심도를 관찰하기 위한 감시 장비와 INM을 위한 마취 방법의 안정적 실행을 위해 현대화된 마취 장비가 잘 갖추어야 있어야 하며, INM 시에는 마취 깊이를 안정적으로 유지하여 안정적 생리 환경을 유지하여 유의한 신호 변화의 해석을 가능하게 함으로써 정확하고 안전한 수술을 보조해야 한다. 선택된 마취방법에서 신경계감시가 적절하게 효과를 발휘하기 위해서는 신경계감시팀이 마취방법에 대한 지식을 바탕으로, 이의 유발전위에의 영향을 판단하는데 능숙해야 환자의 신경학적 손상 예방이라는 최적의 효과를 볼 수 있다. INM을 주도하는 임상 신경생리 전문가는 propofol 및 remifentanil의 천편일률적인 사용이 아닌 수술 종류, 감시하고자 하는 신경구조물에 따라 적절한 신경감시방법을 조합, 구성할 수 있어야 하며, 해당 병원의 마취 여건에 맞추어 마취팀과 상의하에 마취방법을 유연하게 제안, 변경할 수 있어야 한다. 또한 앞으로 propofol을 능가하는 새로운 마취약제가 개발, 도입된다면 다양한 INM 방법에서의 신경생리학적 영향 평가, 유발전위의 파형 변화를 최소화하는 최적의 마취 방법 탐색 등 INM 감시팀의 일원으로서 중추적인 역할을 담당할 수 있어야 하겠다.