서론
수술 중 신경계 감시(intraoperative neurophysiological monitoring, IONM)는 수술 중 발생할 수 있는 신경계의 손상을 효과적으로 방지, 예방할 수 있는 방법으로, 혈관 수술에서도 수술중 신경계감시가 활발히 시행되고 있다[1]. 수술 중 신경계 감시를 위한 전기신경생리적 방법은 뇌파, 유발전위, 신경전도, 근전도, 전기자극술 등이 있다. 뇌동맥류, 경동맥, 대동맥 등 혈관 수술에서 유발전위(체성감각신경전위, 운동유발전위)를 통한 감시가 활발히 시행되고 있으며, 수술에 따라 환자 상태에 맞게 감시 방법을 결정한다[2].
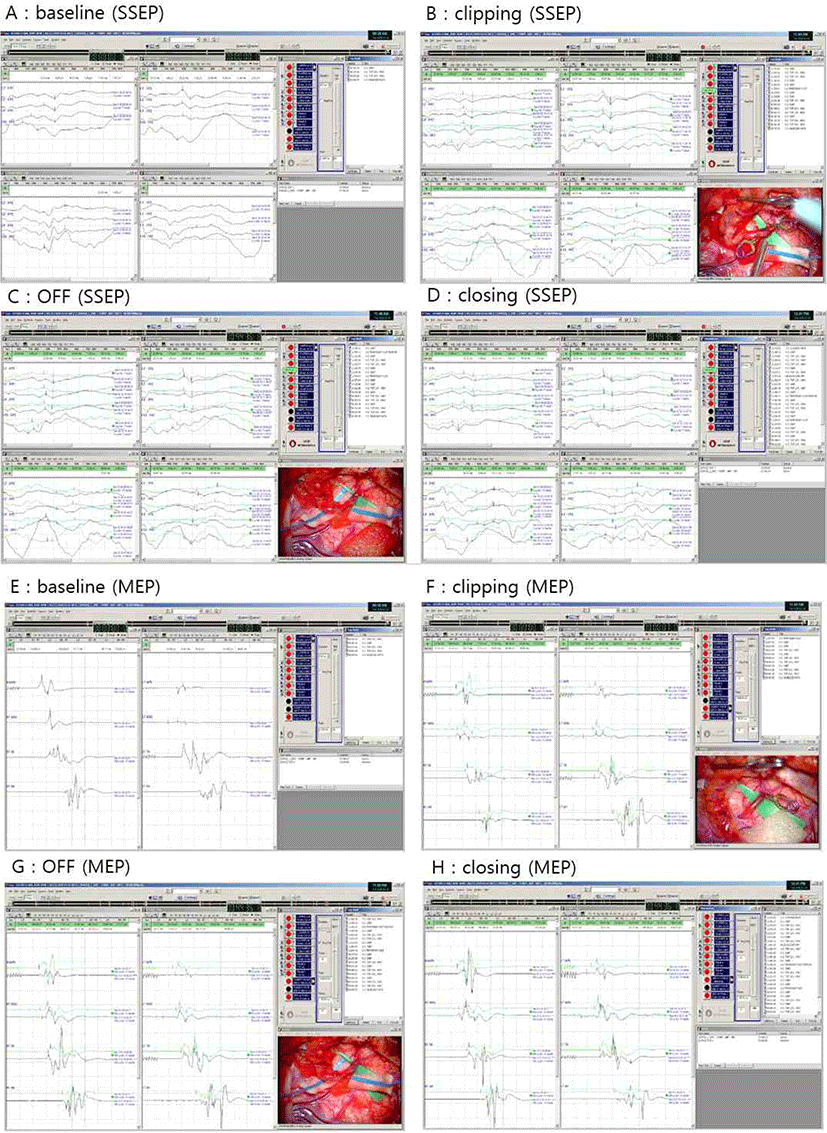
모야모야병(moyamoya disease)은 양측 또는 편측의 내경동맥(internal carotid artery)과 가지에 협착 및 폐색이 발생하며, 비정상 곁순환(collateral circulation)이 형성되는 것을 특징으로 하는 뇌혈관 질환이다. 모야모야병의 합병증으로 일과성 허혈 발작(transient ischemic attack) 혹은 뇌경색이나 뇌출혈 등의 합병증을 일으킬 수 있다. 모야모야병은 주로 수술적 치료를 시행하게 되며, 직접 우회술(direct bypass) 및 간접 우회술(indirect bypass)을 통하여 뇌혈류를 개선하여 합병증을 최대한 막도록 하는 치료가 이루어진다[3]. 직접우회술의 시행과정에서는, 환측의 표재측두동맥(superficial temporal artery, STA)를 중대뇌동맥(middle cerebral artery, MCA)에 연결하게 되는데, 이 과정에서 표재측두동맥을 결찰(clipping)하고, 두 혈관을 문합한 이후 다시 결찰을 풀어주는(clipping removal) 과정을 시행하게 된다[4]. 모야모야병의 혈관 우회술에서 시행되는 수술 중 신경계 감시에서는, 상기 결찰 과정 전후를 포함한 수술 과정에서의 체성감각유발전위(somatosensory evoked potentials, SSEP) 및 운동유발전위(motor evoked potentials, MEP)의 추적 감시를 시행하여 수술 과정에서의 변화를 살펴볼 수 있다.
본론
환자는 24세 남성으로 내원 3주 전 걷다가 우측 상하지에 힘 빠지는 증상이 발생하였으며, 약 15–20분간 증상 지속 후 회복하였다. 이에 타원에서 뇌 자기공명영상 검사 후 모야모야병 의심 하 뇌혈관 조영술을 진행하였으며, 양측 중대뇌동맥(both MCA)의 폐색(occlusion) 소견이 관찰되었다. 특별한 기저질환력 없는 분으로, 본원 내원 당시 신경학적 증상은 관찰되지 않았다. 2019년 12월 31일에 좌측 표재측두동맥-중대뇌동맥 우회술(left STA-MCA bypass) 및 뇌경막동맥간접문합술(encephalo-duro-arterio-synangiosis, EDAS)을 시행하였으며, 수술 2일 후 10분 정도 경미한 구음장애 및 실어증이 관찰되었으나 회복되었고, 이후 신경학적 후유증 없이 퇴원하였다. 2020년 2월 25일에 우측 표재측두동맥-중대뇌동맥 우회술(right STA-MCA bypass) 및 뇌경막동맥간접문합술(EDAS)을 시행하였다. 우측 표재측두동맥-중대뇌동맥 우회술은 우측 표재측두동맥(right STA)의 전두지(frontal branch)를 결찰(clipping)한 후, 우측 중대뇌동맥(right MCA)의 피질지(cortical branch)와 문합(anastomosis)을 시행한 다음 결찰을 제거하는 방식으로 이루어졌다. 수술은 앙와위로 진행되었다. 프로포폴(propofol) 및 레미펜타닐(remifentanil)을 사용한 전정맥마취(total intravenous anesthesia)로 전신마취가 시행되었으며, 기관내삽관을 위해 로쿠로늄(rocuronium)이 사용되었다.
수술 중 신경계감시를 위하여 체성감각유발전위 및 운동유발전위 추적감시를 시행하였다. 체성감각유발전위는 정중신경(median nerve)에서 15 mA의 강도로 0.2 msec 동안 5.1 Hz의 주기로 자극하고, 또한 후경골신경(posterior tibial nerve)에서는 20 mA의 강도로 0.2 msec 동안 5.1 Hz의 주기로 자극한 다음, 4개의 채널(C3’, Cz’, C4’, Fpz)에서 기록하였다. 운동유발전위는 두개경유전기자극(transcranial electrical stimulation)에서 400 V, 5 pulses/train의 빈도로 자극하였으며, 상하지의 abductor pollicis brevis(APB), abductor digiti quinti(ADQ), tibialis anterior(TA), abductor halluces(AH)에서 발생하는 유발전위값을 기록하였다.
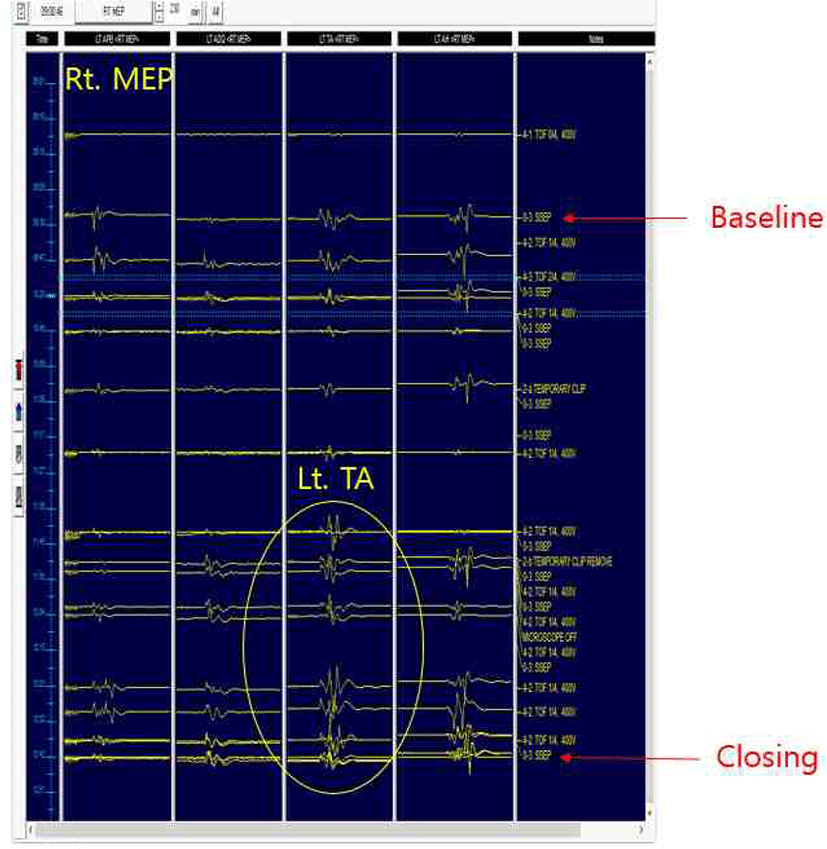
검사 시작 시 체성감각 유발 전위 및 운동유발전위 모두 양측 상하지에서 파형 형성이 잘 이루어지며 기준값(baseline)을 얻을 수 있었다(Fig. 1-A, Fig. 1-E). STA의 결찰(clipping) 및 결찰 제거(clipping removal) 직후 체성감각유발전위 및 운동유발전위에서는 유의한 파형 변화가 관찰되지 않았다. 그러나 수술 종료시 좌측 하지의 운동유발전위에서 유의한 진폭(amplitude)의 증가 소견이 관찰되었다(Fig. 1-H). 수술 종료시의 진폭을 기준값과 비교해 보면, Left TA의 진폭이 211% 증가했음을 알 수 있었다(215.9 μV → 455.6 μV). 체성감각유발전위에서는 진폭(amplitude), 잠복기(latency)에서의 유의한 증가 소견이 관찰되지 않았다. 상기 소견은 stacked wave로도 확인할 수 있었다(Fig. 2).
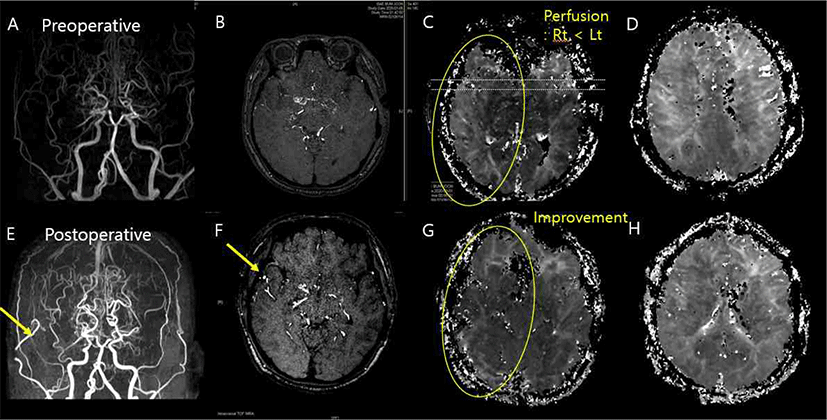
수술 전후의 뇌 자기공명영상을 비교하였다. 수술 전(Fig. 3-A)과 비교하여 수술 후(Fig. 3-E) 뇌 자기공명혈관조영술(brain magnetic resonance angiography, MRA)상 Right STA와 Right MCA cortical branch의 문합(anastomosis)이 이루어진 것을 확인할 수 있었으며, Time-of-flight(TOF) MRA 상에서도 혈류의 호전 소견이 관찰되었다(Fig. 3-B., 3-F). 이를 관류 영상(perfusion imaging) 상에서도 확인할 수 있었는데, 수술 이전과 비교하여 우측두엽(right temporal lobe)의 관류 지연(perfusion delay)이 호전된 소견을 관찰할 수 있다(Fig. 3-C, Fig. 3-F).
결론
본 증례에서는 수술 전후로 체성 감각 유발전위의 파형이 잘 유지되었으며, 유의한 변화가 관찰되지 않았다. 운동유발전위의 경우 전반적으로 파형의 손상 없이 유지되었으며, 혈관 결찰 및 문합 등 수술 과정에 따른 급격한 변화를 보이진 않았으나, 우측 우회술 시행 이후 좌측 운동유발전위의 전반적인 진폭 증가 소견을 확인할 수 있었다. 수술 종료시의 진폭을 기준 값과 비교하였을 때, Left APB에서 77%, Left ADQ에서 164%, Left AH에서 101%의 변화가 확인되었다. 특히 Left TA의 진폭 값이 211%로 증가함을 확인할 수 있었다. 한편, 우측 운동유발전위의 진폭에서도 변화된 소견이 관찰되었다(Right APB 156%, Right ADQ 69%, Right TA 172.4%, Right AH 81.74%). 상기 증례에서 좌측뿐만 아니라, 우측에서도 MEP 증가가 관찰되었지만, APB를 제외하고 ADQ, AH에서도 좌측 운동유발전위의 진폭이 더 크게 증가되었음이 관찰되었다. 수술 중 Train of Four(TOF, 사연속자극비) 값이 대체적으로 1로 유지되었던 상황에서 진폭 상승의 정도가 좌측에서 더 컸다는 점에서 우측 우회술의 효과가 있었다고 볼 수 있을 것이다.
수술 5일 후에 시행한 perfusion MRI 및 MRA 소견에서 STA-MCA 문합 부위의 개통 유지 및 관류 호전 소견이 확인되었고, 이는 수술 중 관찰된 운동유발전위의 향상 소견과 일치한다. 이와 같은 전기신경학적 소견과 영상학적 소견의 일치에 더해 임상 양상의 호전이 있었는지 여부도 확인이 필요하나, 위 환자의 경우 수술 전후 신경학적 결손이 없어 확인할 수 없었다. 전기 신경학적, 영상학적 소견의 호전이 실제 임상 소견과도 연관되는지에 대한 후속 연구가 필요할 것으로 생각된다. 한편, 운동유발전위의 측정과 직접적으로 관련되는 corticospinal tract(posterior limb of internal capsule, corona radiate 등)에서의 뚜렷한 관류 호전 소견은 관찰되지 않았다. 그러나 corticospinal tract에 해당하는 영역은 뇌 자기공명영상의 axial image상 국소적인 부분으로, 본 증례의 영상에서 뚜렷하게 관찰되지는 않은 것으로 생각된다. 본 증례의 경우, 전반적인 관류 호전으로 인하여 운동유발전위의 호전이 관찰된 것으로 보는 것이 타당하겠다.
다른 혈관 수술, 예를 들어 경동맥 내막절제술(carotid endarterectomy)의 경우, 경동맥의 결찰(clamping) 과정에서 발생하는 관류 저하(hypoperfusion)로 인하여 뇌파 활성도의 감소 및 체성감각유발전위의 진폭 감소 등을 유발한다고 알려져 있다[1]. 뇌동맥류(aneurysm)의 수술에서도 혈관의 결찰(clipping) 과정에서 운동유발전위의 변화를 관찰하며 환자의 운동 기능을 감시할 수 있는데[5], 이와 견주어 보았을 때 모야모야병의 혈관 우회술 과정에서 시행되는 표재측두동맥의 결찰 전후로 측정된 체성감각유발전위 및 운동유발전위의 값은, 이번 증례에서는 유의한 차이를 찾을 수 없었다.
본 증례는 혈관 우회술 직후의 운동유발전위 호전에 관한 첫 보고이다. 혈관 수술의 경우, 경동맥 수술[6] 혹은 동맥류 수술[7]에서 뇌파와 체성감각유발전위를 활용하여 관류 정도 및 수술 후 신경학적 악화를 확인 및 예측할 수 있다는 것이 알려져 있다[7,8]. 즉, 수술 전후의 신경학적 변화를 예측하는 과정에서 수술 중 신경계 감시의 유용성이 확인되고 있으며, 모야모야병의 우회술에서도 이와 같은 유용성을 확인할 수 있는 연구들이 향후 더 필요할 것으로 보인다.
모야모야병 환자에서 뇌혈류를 개선하고 예비능(reserve capacity)을 향상시키기 위하여 증상이 있거나 뇌혈류 이상이 있는 경우, 비가역적인 뇌 손상이 발생하기 전에 적극적인 수술적 치료가 필요하다[3]. 수술의 합병증으로는 허혈성 및 출혈성 뇌졸중, 과관류 증후군 등이 발생할 수 있으며[3,9], 본 증례에서는 이와 같은 합병증은 관찰되지 않았다. 모야모야병 수술 중 뇌파(electroencephalography) 감시에 대한 연구에서는, 수술 중 뇌파 변화와 허혈성 합병증의 직접적인 관련성이 보이지는 않았다[10]. 뇌파는 피질의 활성도를 측정할 수 있는 반면, 유발전위는 신경 전도의 합에 대한 정보를 제공할 수 있다는 점에서[2], 혈관 수술 과정에서 발생할 수 있는 직접적인 후유증을 평가하기 위해서는 유발전위가 그 역할을 하기에 적합하다고 생각된다. 이에 모야모야병의 혈관 우회술에서 수술 중 신경계 감시를 통하여 수술 후 합병증을 포함한 예후 예측 및 수술 후 경과 개선에 대한 추후 연구가 필요하다.







