서론
미세혈관감압술(microvascular decompression, MVD)은 삼차신경통(trigeminal neuralgia), 반쪽얼굴연축(hemifacial spasm) 및 혀인두신경통(glossopharyngeal neuralgia)을 유발하는 뇌신경에 대한 비정상적인 혈관 압박을 완화시켜주는 수술이다. 1차적인 약물치료에 충분한 호전을 보이지 않는 난치성 뇌신경병증에 대해, 병의 유발원인인 혈관압박을 제거하므로, 대략 80%에서 100% 사이의 높은 완치율을 보이는 근본적인 치료법으로 알려져 있다[1–3]. 하지만, 이를 위한 MVD 수술 중 필수적으로 시야를 확보하기 위해 소뇌를 뒤로 당기고, 뇌신경을 누르고 있는 혈관(offending vessel)을 확인한 뒤, 신경-혈관 인접부에 Teflon pad 삽입 등의 과정이 필요하다. 이런 과정 중 다리뇌-숨뇌 경계에 있는 청각신경(cochlear nerve)의 손상이 발생할 수 있고, 이는 수술후 청력소실로 이어질 수 있다[4,5]. 과거 MVD 중 수술후 청력소실 발생률은 7.7%에서 20%까지 보고되었다. 하지만, 뇌줄기청각유발전위(brainstem auditory evoked potentials, BAEPs)를 이용한 수술중신경생리검사(intraoperative neurophysiological monitoring, IONM) 검사가 도입된 이후, 수술후 청력소실은 2% 이하로 크게 감소하였고, 현재는 BAEPs를 이용한 IONM은 뇌신경병증에 대한 MVD 시행할 때, 필수적인 검사로 여겨지고 있다[6–8].
본문에서는 뇌신경병증에 대한 MVD 수술에서 활용되는 BAEPs의 파형, 검사방법, 경고 기준 및 주요 변화 양상에 대해 제시하겠다.
파형(waveform)
BAEPs는 국제 10–20 체계로 정수리(vertex) 부위와 귀/mastoid 전극에서 얻어진다[9]. 정수리 부위에서 양극성을 띠는 파형은 위쪽(upward)을 향하는 파형으로 기록되고, 위쪽을 향하는 파형들이 순서대로 로마숫자로 명시된다. 대개 파형은 10 msec 범위 안에서 관찰되고, 파형 I부터 파형 VII 까지 기록되며, 이중 파형 I, III, V가 지속적인 양상을 보여, 외래검사 및 IONM에서 활용된다.
파형 I은 위로 올라가는 파형 중 가장 처음에 관찰되는 파형으로, 동측 귀 전극(Ai)에서 측정이 되므로 동측 채널인 Cz-Ai에서는 관찰되나, 반대측 채널인 Cz-Ac에서는 기록이 되지 않는다. 파형 II는 반대측 채널에서도 처음 관찰되는 파형이고, 동측 채널에서도 유사하게 관찰된다. 파형 III은 양측 채널에서 관찰되고, 대개 동측 채널에서 측정된 것이 반대측 채널과 비교하여 진폭이 크게 관찰된다. 파형 4–5번 복합체(complex)는 BAEPs 중 가장 두드러진 파형이며, 파형 4–5번 복합체 이후 큰 진폭의 음극성의 파형(VN or slow negativity)이 수 msec 동안 이어지므로 쉽게 구별이 가능하다. 또한, 파형 V은 IONM에서 자극세기 및 자극 빈도 변화에 가장 영향을 적게 받으므로, BAEPs를 이용한 IONM 검사의 경고기준(warning criteria)으로 주로 활용된다.
해부학적 기원(anatomical generators)
BAEPs의 기원에 관한 기존의 일부 그림들을 보면, 하나의 해부학적 구조물이 각각 BAEPs의 파형을 유발하는 것처럼 제시되어 있다[10]. 하지만, 실제 BAEPs의 각 파형을 유발하는 해부학적 구조물은 하나가 아닌 보다 복합적인 것으로 알려져 있다[11]. 단, 파형 I을 유발하는 해부학적 구조는 하나인 것으로 알려져 있고, 파형 I 이후의 파형들(파형 II–파형 VII)은 여러 구조물에서 유발된 전위가 합쳐진 것이다. 파형 I은 청각신경의 가장 말단 부위(달팽이구역)에서 유발되는 것으로 알려져 있다. 그러므로, MVD 수술 중 청각신경의 근위부(proximal part; Root exit zone)가 손상될 경우, BAEPs 중 파형 I은 유지되고, 그 이후의 파형의 변화 및 소실이 발생하게 된다. 파형 II는 주로 달팽이핵(cochlear nucleus)의 전위가 포함되며, 일부 청각신경의 전위가 복합되어 유발된다. 파형 III은 위올리브핵(superior olivary complex)을 포함하여 꼬리다리뇌덮개(caudal pontine tegmentum)에서 유발된 전위를 반영한다. 달팽이핵에서 유발된 오름길(ascending tract)은 양측성이기 때문에, 파형 III은 동측뿐 아니라, 반대측에서 유발된 전위를 함께 받게 된다. 또한, 아래쪽 다리뇌의 한쪽에만 병변이 있을 경우, 파형 III은 병변측 동측 귀에서 자극하여 유발된 BAEPs 상에서 보다 크게 영향을 받는 것으로 알려져 있다[11]. 파형 IV와 V의 해부학적 기원은 매우 인접해 있는 것으로 알려져 있고, 파형 IV는 주로 다리뇌의 입쪽 부위(rostral pontine)의 오름청각신경(ascending auditory fibers)의 전위를 반영하는 것으로 알려져 있으며, 파형 V는 중간뇌(midbrain)의 아래둔턱(inferior colliculus)의 전위를 반영하는 것으로 알려져 있다. 파형 VI과 VII은 안쪽무릎체(medial geniculate body)와 같은 보다 상부의 구조물의 전위를 반영하는 것으로 알려져 있다.
검사 방법(methodology)
BAEPs는 음향 신호를 생성하는 트랜스듀서에 100 msec의 전기 펄스를 전달하여 발생하는 클릭 자극에 의해 유발된다. 자극세기는 명확한 BAEPs를 생성하기에 충분히 높게 설정해야 하지만, 청각 손상을 일으킬 정도로 높게 설정할 수 없다. 일반적으로 100 dB sound pressure level(SPL) 또는 60–70 dB hearing level(HL)의 자극세기가 이용되고, 교차반응(crossover responses)를 막기 위해 검사를 행할 때, 반대측 귀에는 60 dB SPL 또는 30–35 dB HL의 백색소음(white noise)을 함께 시행한다. 자극방식은 트랜스듀서 다이어프램의 초기 움직임에 따라 응축(condensation)과 희석(rarefaction)이라는 2가지 방식이 가능한데, IONM에서는 자극 잡파(stimulation artifacts)를 최소화하기 위해 응축과 희석을 번갈아 사용하는 교대극성(alternating polarity) 자극 방식이 주로 사용된다.
우리가 일반적으로 신경생리검사에서 사용한 BAEPs는 한번의 자극으로 얻어진 하나의 BAEP 파형이 아니라, 여러 번의 자극으로 얻어진 복수의 BAEP 파형을 합쳐서 사용하는 것이다. 그렇기에, IONM에서 활용 가능한 BAEPs를 얻을 때, 조작이 가능한 주요한 변수 2가지가 있는데, 이는 자극빈도(stimulus rate)와 평균화횟수(averaging trials)이다. 2006년 미국임상신경생리학회(American Clinical Neurophysiology Society, ACNS) 등은 10 Hz 이상의 자극은 BAEPs 파형의 진폭을 감소시킬 우려가 있어서, 8–10 Hz의 낮은 자극빈도의 검사방법을 권장했다[9,12]. 또한 ACNS에서는 해석 가능하고 재현성 있는 BAEPs를 얻기 위해, 1,000–4,000회의 높은 평균화 횟수가 필요하다고 제시했다. ACNS의 권고를 따라, 10 Hz의 자극빈도와 1,000회의 평균화횟수를 적용한다면, 한번의 BAEPs의 파형을 얻는데 100초의 시간이 소요된다. 병의 유무를 확인하기 위해 시행하는 외래 검사실의 검사라면, 비록 시간이 오래 걸려도 정확한 파형을 얻을 수 있다면 문제가 되지 않는다. 하지만, 수술중 돌발적으로 발생하는 신경손상 유무를 빨리 확인하고, 이를 막아야 하는 IONM에서는 BAEPs를 얻는데 상대적으로 오랜 시간이 걸릴 경우, 이는 주요 신경의 손상 여부를 늦게 발견하여 회복시킬 수 있는 기회를 놓칠 우려가 있다. 하지만, 과거와 달리 IONM 장비의 발전으로 신호-잡음 비(signal to noise ratio)가 개선되고, 고빈도 자극을 사용할 때 발생할 수 있는 파형 왜곡이 감소하여 고빈도 자극 검사가 가능해졌다. 실제로, 2016년 저자를 포함한 국내 연구진은 43.9 Hz의 자극빈도와 400회의 평균횟수를 적용하였을 때, 신뢰할 수 있는 BAEPs를 얻는 것이 가능함으로 보고하였고, 하나의 해석 가능한 BAEPs 얻는데 걸리는 시간을 10초 미만으로 단축시켰다[13]. 더 나아가, BAEPs 측정의 새로운 방식을 적용하였을 때, 이전 방식과 비교시에 수술후 청력소실을 크게 감소시킬 수 있음을 제시하였다(4.02% vs 0.39%, p=0.002). 최근, 다른 많은 연구진들도 자극빈도 및 평균화 횟수에 변화를 주어, 30초 이내에 해석이 가능한 BAEPs를 얻는 방식을 적용하여 IONM에 활용하고 있다[14,15].
경고 기준(warning criteria)
BAEPs의 IONM을 사용할 때, BAEPs의 여러 파형 중 주로 파형 V가 이용된다[16]. 이는 파형 V가 다른 파형에 비해 분명하고, 마취에 대해서도 상대적으로 영향을 덜 받기 때문이다. 이 지난 40년간 BAEPs를 이용한 IONM 적용할 경우, MVD 중 수술후 청력소실을 예방할 수 있다는 분명한 증거들이 많이 있었다[17]. 하지만, 여전히 수술후 청력소실을 예측하는 BAEPs의 경고 기준에 대한 합의가 이루어지지 않았다. 과거, Polo 등은 파형 V의 잠복기가 0.6 msec 연장되는 것이 수술후 청력소실과 연관성이 높다고 제시하였다[18]. Grundy 등은 wave V의 잠복기가 1.5 msec 연장될 경우를 경고 기준으로 사용해야 한다고 제시했다[19]. 반대로, Hatayama와 Møller 등은 파형 V의 잠복기 연장은 항상 파형 V의 진폭 감소와 동반되고, 수술 후 청력 소실을 보였던 환자에서 파형 V 진폭 감소가 잠복기 연장보다 유의한 차이를 보였기에, 파형 V의 진폭 감소가 보다 유용한 경고 기준이라고 주장하였다[20]. 최근, Thirumala 등은 파형 V의 잠복기 연장 혹은 진폭의 감소보다는 파형 V가 일시적 혹은 영구적으로 소실된 경우가 수술 후 청력 소실과 직접적인 연관성이 있다고 보고하였다[14]. 그들은 파형 V의 잠복기 1 msec 연장 혹은 진폭의 50% 감소를 보인 환자 중 10.2%, 일시적인 파형 소실을 보인 환자는 25%, 그리고 영구적인 소실을 보인 환자들 중 60%가 청력 소실로 이어졌다고 보고하였다. 위와 같이 과거 유용한 경고 기준에 대한 많은 연구가 있음에도 불구하고, 이에 대한 공통된 기준이 부재했었다. 여전히 많은 연구자들은 경험적으로 2회 연속 BAEPs 상 파형 V의 잠복기 1 mec 연장 혹은 진폭 50% 감소를 알람 기준으로 사용하였다. 하지만, 부정확한 경고기준은 매우 심각한 문제이다. 경고 기준이 부정확할 경우, 이를 확인하고 교정하기 위해 불필요하게 수술시간이 지연되고, 더 나아가 불필요한 조작으로 수술 중 합병증으로 이어질 위험이 있기 때문이다. 이에 대해 삼성서울병원에서는 수술 후 청력 소실과 연관된 경계 기준을 확립하기 위해, 932명의 반쪽얼굴연축 환자를 대상으로 시행된 MVD 중 기록된 BAEPs와 수술 후 청력 소실과의 연관성을 분석하였다(Table 1). 그들은 해석 가능한 하나의 BAEPs를 얻기 위해 43.9 Hz 자극 빈도와 400회의 평균화 횟수를 시행하여, 약 9.1초 만에 BAEPs 파형을 얻는 방식을 적용하였고, 총 932명의 환자 중 11명(1.2%)의 환자에서 수술 후 청력 소실이 관찰되었다. 수술 중 BAEPs의 최대 변화를 기준으로 분석하였을 때, 파형 V의 영구적인 소실을 보인 환자가 11명이었는데, 이중 6명(54.5%)이 수술 후 청력 소실을 보였고, 파형 V의 일시적인 소실을 보인 환자 27명 중 2명(7.4%), 그리고 파형 V의 잠복기 1 msec 연장 혹은 진폭 50% 감소를 보인 환자 96명 중 2명(2.0%)의 환자가 청력 소실로 이어졌다. 반면, 파형 V의 진폭 감소 없이 잠복기만 1 msec 이상 연장된 환자는 총 194명이었는데, 이 환자들은 수술 후 청력 소실로 이어지지 않았다. 심지어, 잠복기 연장만 보인 194명의 환자들 중 30명의 환자는 2 msec 이상의 잠복기 연장으로 보였으나, 이 환자들 또한 수술 후 청력 소실로 이어지지 않았다. 연구진들은 MVD 중 수술 후 청력 소실을 예측하기 위한 BAEPs 경계 기준의 타당성을 계산하였고, 파형 V의 영구적인 소실은 99.4%의 높은 특이도를 보였으며, 일시적인 소실은 96.7%, 진폭 50% 감소를 동반한 잠복기 1 msec 연장은 86.5%의 특이도를 보였다고 발표하였다. 이런 연구 결과를 바탕으로, 그들은 현재 통용되고 있는 파형 V의 잠복기 1 msec 이상 연장 혹은 진폭 50% 이상 감소의 경고 기준은 수술 후 청력 소실을 예방하는데 부적절하다고 주장하였다. 그리고, 더 나아가 MVD 중 수술 후 청력 소실을 예방하기 위한 경고 기준에 대해 다음과 같은 ‘단계적 등급(sliding scale)’이 보다 적절하다고 제안하였다(Table 2)[21]. 1) 관찰 징후(observation sign): 파형 V의 진폭 50% 감소 없이 잠복기만 1 msec 이상 연장; 2) 경고 징후(warning sign): 파형 V의 진폭 50% 이상 감소와 함께, 잠복기 1 msec 이상 연장; 3) 위험 징후(critical sign): 파형 V의 소실. MVD 수술 중 관찰 징후(observation sign)가 관찰될 경우, 검사자는 이를 집도의에게 바로 알리나, 집도의가 이에 반응하여 BAEPs 회복을 위한 조치를 취하기 않는다. 하지만 경고 징후(warning sign) 혹은 위험 징후(critical sign)가 관찰될 때에는, 검사자가 이를 바로 집도의에게 전달하고, 집도의는 이에 반응하여 진행 중인 수술을 중단하고, 이를 교정하기 위해 조치를 취하는 것을 제안하였다.
주요 변화 양상(major change patterns)
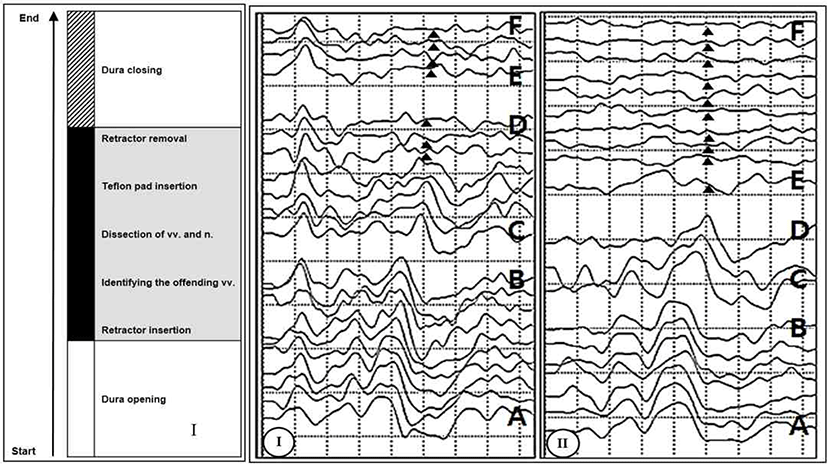
위험 징후인 파형V의 소실이 발생할 때, 2가지의 다른 변화 양상이 발생하게 된다. 일부 환자는 파형 I를 포함하여 모든 BAEPs 파형이 소실되는 양상을 보이고, 다른 환자는 파형 I은 유지된 상태에서 파형 II부터 소실을 보이게 된다(Fig. 1). 파형 I이 청각신경의 가장 말단 부위(달팽이구역)에서 유발되기 때문에, 달팽이구역의 손상이 발생하는 경우 파형 I을 포함한 모든 BAEPs 파형의 소실을 보이게 된다. 달팽이구역은 앞아래소뇌동맥(anterior inferior cerebellar artery)의 분지인 내부청각동맥(internal auditory artery)를 통해 혈액공급을 받기 때문에, 주로 혈관연축(vasospasm)에 의한 달팽이구역 경색증(cochlear infarction)이 발생할 경우 이런 변화를 보이게 된다[22]. 또한 드릴작업(drilling) 혹은 뇌줄기 방향으로 청각신경의 과도하게 잡아 당겨질 때, 달팽이구역의 미로(labyrinth)가 손상될 경우에도 파형 I을 포함한 모든 BAEPs 파형의 소실이 발생할 수 있다. 반면, 파형 I은 유지되고, 그 이후의 파형들만 소실되는 경우는 MVD 과정 중 청각신경의 근위부(proximal part; Root exit zone)가 직접적으로 손상되어, 달팽이구역 및 청각신경의 말단부위의 손상이 없을 때 발생한다[10,23]. 저자를 포함한 연구진은 반쪽얼굴연축 환자에서 MVD 수술 중 파형 V를 보인 36명의 환자를 분석하였을 때, 그 중 24명(66.7%)의 환자는 파형 I를 유지한 양상을 보였고, 12명(33.3%)의 환자는 파형 I를 포함하여 모든 파형의 소실을 보였다[24]. 이런 변화가 발생하였을 때, 경고 기준에 따라 수술을 중단하고, 적절한 조치를 취했음에도 총 8명의 환자에서 수술후 청력 소실을 보였고, 이 중 6명의 환자가 파형 I을 포함한 모든 파형의 소실을 보인 환자들이었다. 또한 파형 I을 포함한 모든 파형의 소실을 보인 환자들은 수술 후 청력 소실 외에 어지러움증, 이명(tinnitus), 복시(diplopia) 및 쉰소리(hoarseness) 등 다른 후유증들이 보다 빈번하게 관찰되었다. 이를 통해, 파형 V의 소실을 보인 환자 중에서도, 파형 I부터 소실을 보인 환자들은 보다 심각한 수술 후유증으로 이어질 수 있으므로, 보다 많은 주의가 필요하다고 보고되었다.