서론
퇴행성 병변뿐만 아니라, 선천성 기형, 감염, 외상, 종양 등 다양한 병변이 척추와 척수 또는 척추 신경을 침범하여 척추의 기능을 훼손할 경우, 환자들에게 통증, 감각 또는 운동 마비, 대소변 장에, 보행 장애, 직립 자세 균형 유지 장애 등 다양한 증상이 발생할 수 있다. 척추의 수술적 치료는 이러한 장애가 발생한 환자들에서 외과적 술식을 이용하여 척추의 기능을 유지 회복하는데 도움을 줄 수 있는 경우에 시행하게 된다. 척추의 수술적 치료를 위해 사용되는 외과적 술식은 크게 척추관내 척수 또는 척추 신경을 압박하는 병변을 제거하기 위해 시행하는 감압술(decompression), 그리고 종양 또는 감염 등의 병소를 직접 제거하기 위한 종양제거술 및 병변 제거술, 척추의 안정성을 회복하기 위한 기기고정술 및 유합술(instrumentation and fusion)과, 다양할 술식을 응용하여 변형을 교정을 목적으로 시행하는 변형 교정술(deformity correction) 등이 있다. 이러한 척추의 외과적 치료는 약화된 신경 조직 인접 부위에서 물리적 조작을 가하거나, 척수 혈류 공급 등에 영향을 미칠 수 있으므로, 필연적으로 척수와 척추 신경의 기능을 오히려 악화시킬 위험이 있다. 대표적으로, 심한 경추 또는 흉추의 압박성 척수증 치료를 위해 감압술을 시행하는 경우(후종인대골화증 및 황색인대 골화증 등), 원발성 또는 전이성 척추 종양이 신경을 압박하고 있거나, 척수 또는 척추 신경에 발생한 종양을 제거하는 경우, 심한 척추 변형이 있어 변형 교정과정 중에 또는 왜곡된 해부학적 구조를 통해 기기를 삽입하는 과정 중에 신경 기능이 오히려 악화할 위험이 크다. 이러한 신경학적 위험은 난치성 척추 질환의 외과적 치료에 대표적 장애물이다. 하지만 최근의 수술 중 신경계감시(intraoperative neurophysiological monitoring, IONM) 기법의 발전과 보급은 이러한 고위험 척수 수술에서 신경학적 합병증 발생의 예방과 보다 적극적인 외과적 치료 이용에 큰 도움을 주고 있다. 본 종설에서는 IONM을 사용하는 척추 수술의 각 종류에 따른 IONM의 활용과 유용성에 대한 최근의 연구들을 종합해 보고, IONM을 척추수술에 이용한 저자의 경험을 공유하고자 한다.
본론
척추 수술의 수술 중 신경계 감시에 사용되는 검사 종류 및 활용법에 대해서는 지난 대한수술중신경계감시 학회 종설에서 자세히 다뤄졌기 때문에[1] 이번 종설에서는 간략히 언급할 예정이다.
체성감각유발전위(somatosensory evoked potential, SSEP)는 척추 수술 중 척수 감시 방법으로 가장 먼저 이용되었으며, 가장 흔하게 이용되고 있다[2,3]. 이것은 말초 신경에서 자극하고 두피에서 기록하여 척수의 기능에 이상 유무를 알아내는 방법으로써, 유발전위는 척수의 감각신경로가 위치한 척수의 후주(posterior column)를 따라 전달되므로 이 부위의 이상 유무를 감시한다[3]. SSEP는 수술중 지속적인 감시가 가능하지만, 해석에는 시간적 가중(temporal summation)이 필요하므로 신호변화 감지가 최대 16분까지 지연될 수 있다[4]. 또한, 임상적으로 보다 중요한 운동경로에 대한 기능을 직접적으로 평가하지 못하는 한계가 있으며, 전방 척추 동맥(anterior spinal artery)의 혈액 공급에 이상이 발생하는 경우, 척수의 전방 2/3에만 허혈성 손상이 나타나게 되므로 척수의 후주는 보전되어 이론적으로 SSEP에는 이상소견이 나타나지 않을 수 있어 수술 중 SSEP 단독감시에 대해서 안전문제를 제기한 여러 보고들이 있다[4–6].
운동유발전위(motor evoked potential, MEP)는 경두개전기자극(transcranial electrical stimulation, TES)으로 발생한 유발 전위를 상지 및 하지의 근육에서 기록하는 것으로, 운동 경로인 피질 척수로(corticospinal tract)를 평가할 수 있다. 발생한 MEP는 수술부위보다 원위부의 척수의 경막외(epidural)나 경막하(subdural) 공간에 삽입한 전극을 통해서 기록(D-파형, D-wave)하거나, 상하지 양측 원위 말단부 근육에서 기록(근육 MEP, muscle MEP)할 수 있다[7]. MEP는 수술 후 발생한 새로운 신경결손을 감지하는 데 신뢰할 수 있는 것으로 나타났지만[4,8,9], 흡입마취제에 매우 민감하게 영향을 받기 때문에 정맥 마취가 필요하며, 자극 후 근육의 단일수축을 일으켜 환자가 움직일 수 있으므로 지속적인 감시가 어렵고, 특히 턱 주위 근육의 수축에 의한 손상에 주의해야 한다[2,10,11].
근전도(electromyography, EMG)는 신경근과 말초신경을 감시하는데 사용되며, 척추기구고정술(spinal instrumentation) 중 손상 위험이 높은 신경근의 손상을 감시하는 데 유용하다[12]. 자발 근전도(spontaneuous electromyelography, sEMG)는 SSEP와 마찬가지로 수술 중 계속해서 기록할 수 있어 전체적인 수술과정 중 실시간 감시(real-time feedback)가 가능한 이점이 있다[13]. 자발 근전도는 신경근접합부 차단제에 영향을 받고, 온도변화에도 민감한 경향이 있어 여러 연구에서 신경근 손상에 대해 민감도는 높지만, 특이도는 낮은 것으로 보고되었다[5]. 유발 근전도(triggered electromyography, tEMG)는 척추경 나사(pedicle screw)가 척추경에 잘 삽입되었는지를 평가할 때 사용할 수 있으며, 자극기로 삽입된 척추경 나사의 머리나 경부에 전기 자극을 가하고 해당 신경근의 지배근육에서 근전도 검사를 시행하여 평가한다. 부적절한 나사못 경로(trajectory)에 의한 척추경 골절에 의한 틈(pedicle breach)이 있는 경우에는 낮은 강도의 역치값(threshold)이 측정되며, 요추부에서는 5 mA, 흉추부에서는 6 mA 미만이면 척추경 골절에 의한 틈이 있을 가능성이 높을 것으로 알려져 있다[14,15]. 같은 원리로 tEMG는 측방 추체간 유합수술(direct or extreme lateral interbody fusion, DLIF or XLIF)시 요근(psoas muscle)을 분리하여 접근할 때 손상 위험이 높은 요추 신경총(brachial plexus)의 위치를 알아볼 때에도 사용되고 있다[16].
SSEP, MEP, EMG를 이용하여 척수와 신경근을 모두 감시하는 것을 다중 모드 수술 중 신경 감시(multimodal intraoperative neuromonitoring, MIONM)라고 한다. MIONM은 단일방법 감시보다 신경 손상을 감지하는 민감도와 특이도가 높은 것으로 보고되었으며, 척추수술 중 신경계 감시의 표준이 되었다[2,3,17,18].
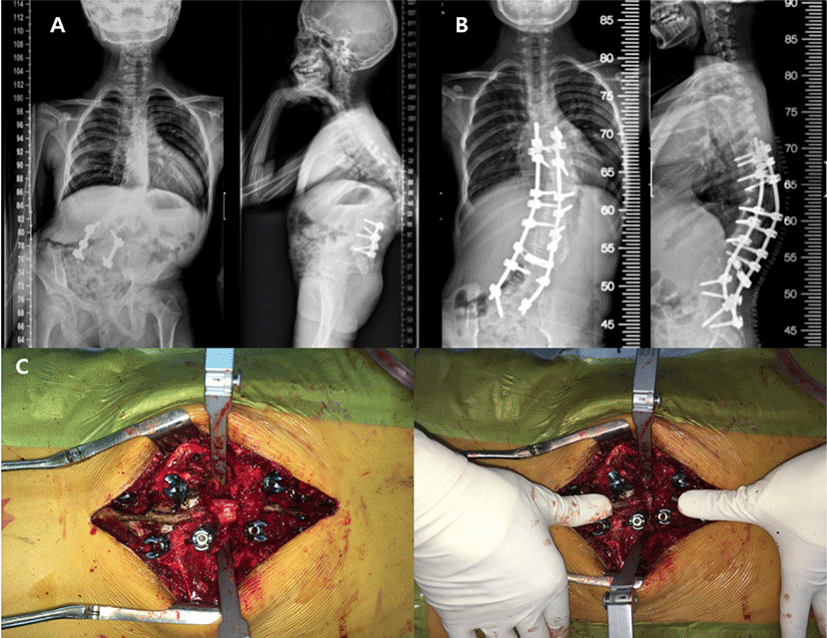
수술 술기 및 기기의 발전으로 점차 더 복잡한 척추 변형 교정수술이 가능해지고 있지만, 변형교정각도가 클수록 신경조직에 가해지는 물리적, 허혈적 손상 발생 가능성이 증가하여 사지의 운동 및 감각기능 상실과 장 및 방광기능 저하 등의 신경학적 손상이 발생할 위험이 있다. Scoliosis Research Society(SRS)의 Morbidity and Mortality Committee는 척추 변형 교정수술의 신경학적 합병증은 드물지만, 잠재적으로 매우 치명적인 위험성을 갖는다고 보고하였다[19–22]. 모든 척추 변형 교정 수술에서 후만증(kyphosis), 선천성 척추 측만증(congenital scoliosis), 수술전 기존의 신경학적 이상소견이 있는 경우 위험성이 증가하며(1.3%–3.6%), 척추경 제거 절골술(pedicle subtraction osteotomy, PSO)과 후방 척추체 전 절제술(posterior vertebral column resection, PVCR)과 같은 고위험 술기의 사용은 독립적으로 수술의 위험성을 증가시킨다[23]. 척추 변형 교정 수술 중 발생하는 신경학적 손상의 원인은 비정상적인 해부학적 구조로 인한 잘못 삽입된 척추경 나사못에 의한 직접 손상부터 강직되어 있는 변형에 대한 교정 시 척수를 압박하거나 신연시켜 발생하는 손상, 척수의 부종 및 간접적 허혈(indirect ischemia)과 직접적인 혈관 손상에 의한 직접적 허혈(direct ischemia)에 이르기까지 다양하다(Fig. 1)[24].
1977년 Nash 등에 의해 보고된 SSEP 감시법의 사용은 척추측만증 수술 중의 신경학적 손상 발생률을 크게 감소시키는데 공헌하였다. Nuwer 등이 SRS 회원들을 대상으로 SSEP의 사용 및 그 결과에 대해 설문조사를 실시한 연구결과, 총 97,586건의 척추수술 중 51,263건(53%)의 수술에서 SSEP 감시가 사용되었으며, 92% 민감도, 98.9% 특이도를 보였고, 42%의 양성예측률과 99.9%의 음성예측률을 보였다[3]. 하지만 SSEP 감시의 위양성 변화에 대한 보고가 증가하면서 SSEP 단독 감시에 대한 우려가 대두되었으며, MIONM에 대한 여러 연구들이 진행되었다[25,26]. Quraishi 등이 MIONM을 이용한 성인 변형 교정수술환자 102명을 후향적으로 분석하였고, 100% 민감도, 84% 특이도, 양성예측률은 14%, 음성예측률은 97%였다. 절골술을 포함한 복잡한 변형 교정 수술을 시행한 환자군에서는 67% 민감도, 98% 특이도, 양성예측률은 80%, 음성예측률은 96%였다[5]. Pastorelli 등도 마찬가지로 172명의 측만증 환자의 결과를 발표했으며, MIONM을 사용하여 각각 100%와 98%로 향상된 민감도와 특이도를 확인하였다[27]. 그러나 Hamilton 등은 MINOM에 대한 이전의 연구결과와 상반되는 결과를 보고하였다. SRS morbidity and mortality database에 등록된 100,000례의 척추수술에 대한 분석결과, MIONM을 이용한 65%의 수술에서 수술 후 신경학적 결손에 대한 민감도는 43%, 특이도는 98%, 양성예측률은 21%, 음성예측률은 99%를 보였다[12]. 이 연구결과로 MIONM의 우월성에 대한 추가적인 연구의 필요성이 강조되었다. 보다 최근에 Bhagat 등은 354명의 척추변형수술 환자를 대상으로 한 대규모 후향적 분석연구 결과를 발표했으며, SSEP와 MEP 복합감시의 민감도는 100%, 특이도는 99.3%로 척추 변형 수술에서 MIONM이 단독 감시법보다 우월하다는 근거를 제시하였다[28].
경추 수술은 척수병증, 신경근병증, 척추관협착증, 골절, 종양 등을 포함하는 다양한 경추 질환에서 필수적인 치료방법으로 고령화, 발전된 영상진단 기술, 수술 술기 및 기기의 발달로 지속적으로 증가하고 있다. 신경학적 합병증의 가능성은 척추 변형 교정 수술과 같은 경우보다는 낮지만(0.3%–3.2%) 퇴행성 경추 질환의 수술에서 IONM의 사용은 점점 더 증가하고 있다[29–31]. SSEP가 현재 가장 일반적으로 사용되는 감시 방법으로 수술 중 감시목적뿐만 아니라, 경추 수술을 위한 체위 변경 후 척수 및 신경근에 대한 평가에 이용된다[32–34]. 그러나 단독 SSEP 감시의 낮은 특이도에 대한 보고로 많은 연구자들은 고위험 경추수술 중 단독 감시방법으로 사용하지 말 것을 권장하였다[2]. 한편, MEP 감시법에 대해서 Clark 등은 퇴행성 경추척수증 환자의 수술에서 71%의 민감도, 94%의 특이도를 보고하였으며, Hilibrand 그룹에서 427명의 경추 수술 환자들을 후향적으로 분석하여 SSEP와 MEP 감시법을 비교한 연구에 따르면, 총 12명의 환자에서 수술 도중 유의미한 MEP 진폭의 감소가 나타났고, 이 중 수술 종료 전에 MEP 진폭이 회복된 10명은 새로운 신경학적 결손은 없었다. 수술 종료시까지 MEP 소실이 지속되었던 나머지 2명은 수술 후 위약감이 발견되어, MEP 검사는 100%의 민감도 및 특이도를 기록했다. 반면, 수술 중 유의미한 MEP 변화를 보인 12명 중 9명은 SSEP에서 아무 변화가 없었으며, 수술 후 위약감이 발견된 2명의 환자 중 1명만 SSEP의 이상소견이 기록되어 25%의 민감도, 100%의 특이도를 기록했다. 따라서 저자들은 경추수술 중 운동신경로 감시에 대해서 MEP가 더 우월하다는 근거를 제시하였다. 마찬가지로 Kim 등도 200명의 전방경추수술 환자들을 후향적으로 분석하여 MEP 감시의 유용성에 대해서 보고하였다[35]. 또한, Fujiwara 등은 경추 후궁 성형술후 발생하는 제5경추 신경근 마비의 감시에 대해서 MEP의 유용성에 대해서 보고하였으며, 수술 종료 직후 확인된 급성형 마비의 경우 예측 가능하였으나, 이후 발생하는 지연성 마비는 예측하지 못했다[36]. 앞서 기술한 바와 같이 SSEP 또는 MEP 단독감시의 안전성에 대한 우려가 보고되면서 MIONM이 경추부 감압수술 중 신경계 감시의 신뢰도를 개선하기 위한 보완방법으로 모색되었으며, MIONM에 대한 연구들이 발표되었다[2]. Eggspuehler 등은 246명의 수술중 MIONM을 사용한 경추부 척추관 협착증 환자에 대한 전향적 연구를 통해서 83.3%의 민감도와 99.2%의 특이도를 보고한 반면, Lee 등은 경추 후방 수술중 MIONM을 사용한 182명의 환자들을 후향적 분석한 결과, 50%의 민감도와 100%의 특이도를 보고했다. 하지만 낮은 민감도에도 불구하고, 저자들은 MIONM의 유용성을 지지하였으며, 경추 후방수술후 발생한 지연성 제5경추 신경근 마비가 위음성결과에 영향을 준 것으로 설명하였다[37].
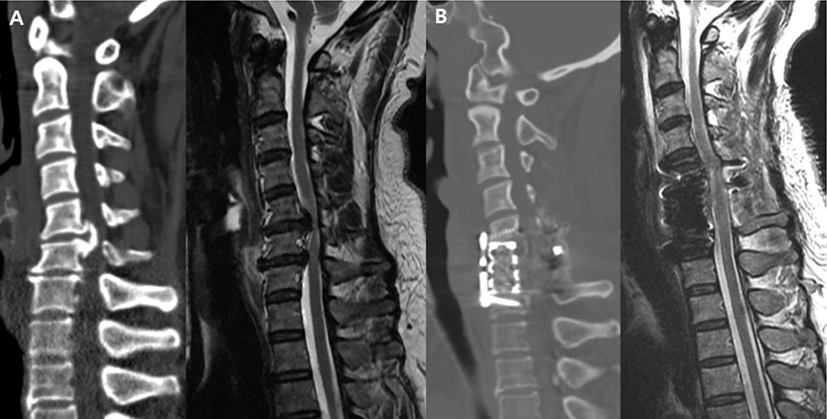
경추 수술중 신경계 감시장치의 사용을 지지하는 많은 연구들이 보고되었지만, 일반적인 경추 수술에서 신경계 감시장치를 일괄적으로 사용하는 것이 유용한가에 대해서는 이견이 많다. Traynelis 등은 척추 종양이나 변형 등을 제외한 일반적인 퇴행성 및 외상성 그리고 기타 척추 질환에서 경추 수술을 시행받은 환자 720명을 대상으로 후향적으로 분석한 결과, 신경계 감시장치를 사용하지 않아도 안전하다는 결과를 보고하였으며[38], Ajiboye 등도 일반적인 경추 전방 추체간 유합술(anterior cervical discectomy and fusion, ACDF) 증례 15,395건을 분석하여 신경계 감시 장치를 사용한 경우와 그렇지 않은 경우에 신경학적 합병증의 발생빈도 차이가 없었다고 보고하였고, ACDF 수술중 신경계 감시 장치를 사용하는 빈도가 점차 감소하여 2011년 이전에는 약 30% 정도였으나, 이후 지속적으로 감소하여 10% 이하로 줄어들었다고 보고하였다[39]. 하지만 ACDF와 같은 일반적인 술식에서도 후종인대 골화증이 심하게 척수를 압박하고 있는 경우 등에서는 수술중 신경계 감시 장치가 유용함을 보고하고 있는 연구도 있다[40]. 저자의 경우, 일반적인 경추 신경근 병증 환자의 수술에서는 수술중 신경감시 장치를 사용하지 않지만, 변형이 심하거나 척수압박이 심한 척수증에 대한 수술의 경우 MIONM을 활용하여 신경학적 합병증을 최소화하고 있다(Fig. 2).
척추종양 수술에서 신경계 감시장치의 진단적 가치에 대해서는 많은 연구들이 발표되어 왔다. Daniel 등은 수질내(intramedullary) 종양의 경우, 수술 중 신경계 감사장치를 사용한 환자에서 신경학적 결손이 감소하는 경향을 발표하였고[41], Sutter 등은 MIONM을 사용한 경막내(intradural) 종양 환자 109명을 조사하여 92%의 민감도와 99%의 특이도를 보고하였다[42]. Forster 등이 경막내 종양제거 수술을 시행한 203명의 환자들을 후향적으로 분석한 연구에서 47명(23.2%)의 환자에서 유의미한 변화가 관찰되었고, 수술 후 신경학적 결손에 대한 SSEP의 민감도와 특이도는 각각 94.4%와 96.8%, MEP는 각각 95%와 98.9%였다[43]. 경막내 수외(intradural extramedullary, IDEM) 종양에 대해서도 긍정적인 연구결과들이 발표되었다. Korn 등은 100건의 증례에 대해서 분석한 결과, 민감도와 특이도는 각각 94.4%와 96.8%, 양성예측률은 82%, 음성예측률은 95%를 보였다[44]. Harel 등도 41명의 경막내 수외 종양 제거수술 환자에 대해서 분석했을 때, 민감도와 특이도는 각각 75%와 100%, 양성예측률은 100%, 음성예측률은 97%를 보였다[45]. 수술중 신경계 감시 장치를 사용하지 않은 환자군과의 비교 연구결과에서도 MIONM의 유용성을 뒷받침해주는 결과가 보고되었다. Sala 등은 수질내 척수종양 절제 수술을 시행한 환자들중 MIONM을 사용한 환자군 50명과 사용하지 않은 환자군 50명을 비교하여 MIONM 환자군에서 유의하게 양호한 신경학적인 예후를 보고하였다[46]. 척수 종양 수술에서는 D-파형의 감시를 통해 더욱 정확한 신경학적 예후를 예측할 수 있다고 알려져 있다. MEP가 소실된 이후에도 D-파형의 진폭이 50% 미만으로 감소한다면 이는 수술 후 일시적 운동 결손을 의미하는 것이지만, D-파형의 진폭이 50% 이상 감소한 경우, 수술 후에 영구적인 운동기능 저하가 나타남을 의미한다고 알려져 있다[47,48].
2018년에 Kumar 등은 전이성 척추 종양(metastatic spine tumor) 수술중 신경계 감시를 시행한 135명의 환자들을 분석한 연구결과를 발표하였다. 수술전 American Spinal Injury Association(ASIA) 등급 D(척수 손상 이하 부위 도수 근력 등급 3 이상) 이상인 환자들에서 MIONM을 사용하여 기준신호(baseline signal)를 안정적으로 기록할 수 있었으며, 민감도와 특이도는 각각 99.1%와 100%, 양성예측률은 100%, 음성예측률은 92.9%로 보고하였다. 그러나 수술 전 ASIA등급 A에서 C까지의 환자에서는 비용-효과(cost-effective)를 고려할 때 추천되지 않으며, 기기 고정술 및 감압술이 필요한 ASIA등급 A또는 E 환자에서의 유용성을 보고하였다[49].
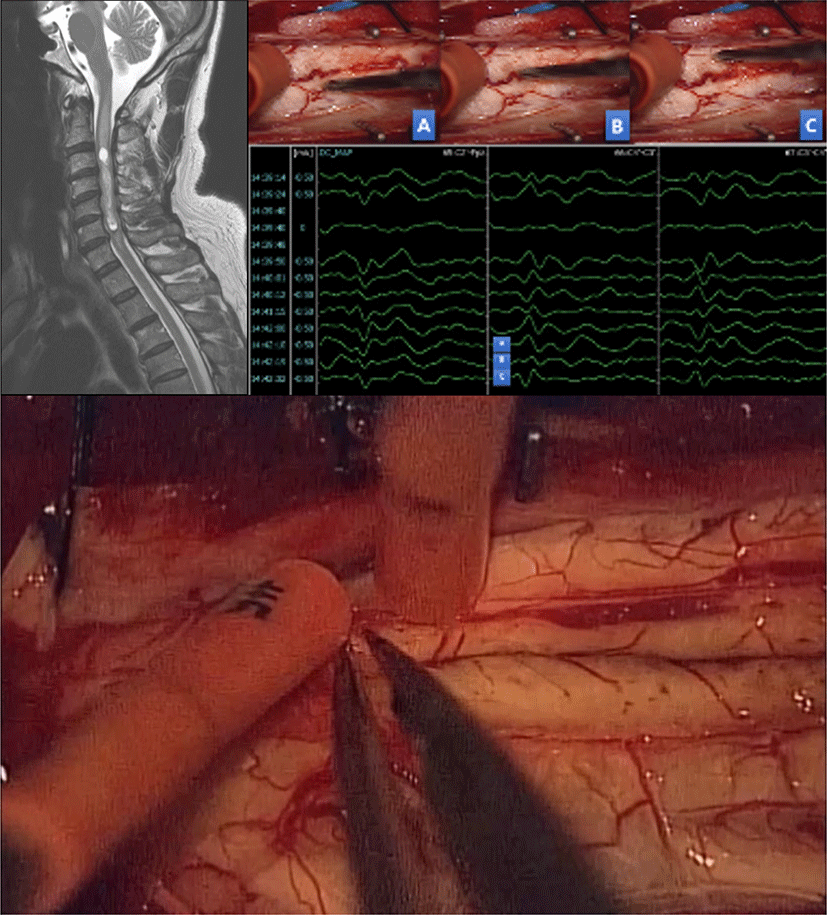
또한 SSEP는 수질내 척수종양 수술에서 척수내 종양에 접근을 위한 척수절개(myelotomy)시 척수 후방의 중앙부(midline)의 위치를 정확히 찾는 데 유용하게 사용되고 있다. 척수종양 수술후 발생할 수 있는 후주이상증후군(dorsal column dysfunction syndrome)은 대부분 척수절개술 중 발생한 척수 후주 손상이 원인으로 이를 예방하기 위해서 정확한 중간선 접근이 필요하다. 육안으로 해부학적 구조물을 파악해 중간선을 정할 수 있으나, 종양으로 인해 구별하기 어려운 경우가 흔히 있으며, 이때 SSEP를 이용한 후주지도화(dorsal column mapping)로 생리학적 중앙부를 찾을 수 있다(Fig. 3)[47,48].
앞서 서술한 바와 같이 IONM이 소개된 이례로 척추 수술에서 IONM의 진단적 가치는 많은 연구결과들이 발표되었고, 실제 많은 척추 수술에서 이용되고 있다. 비록 비용-효과적인 측면에서 아직 이견이 있지만[41], 고위험 척추 수술에서 IONM의 사용으로 수술 중 발생한 신경손상이 영구적인 신경학적 결손으로 이어지지 않도록 감시하고, 중재(rescue)할 수 있다는 것은 분명하다고 할 수 있다[50], 최근에는 한걸음 더 나아가 수술 중 IONM 신호의 호전을 보이는 경우에 대해서 관심을 갖고 IONM이 수술 후 신경학적 회복을 예측하는 도구로 사용할 수 있는가에 대한 연구들이 이어지고 있다. 본 저자는 수술중 IONM을 사용한 317명의 환자들을 대상으로 진행한 연구에서 29명(9.1%)의 환자(MEP: 10명, SSEP: 12명, MEP & SSEP: 5명)에서 신호의 호전을 확인하였으며, 호전된 환자들은 모두 수술전에 비해서 운동기능 및 주관적인 증상이 호전된 것을 보고하였다[51]. Wang 등은 59명의 경추 압박성 척수증(cervical compressive myelopathy) 환자들을 대상으로 수술 중 MEP 신호변화에 따라서 호전(improved), 유지, 감소(degeneration) 세 군으로 나누어 수술후 초기 및 장기적인 신경학적 예후를 비교하였으며, 신호호전군에서 더 좋은 신경학적 회복을 보고하였다[52]. Park 등도 마찬가지로 경추 압박성 척수증 환자들을 대상으로 시행한 연구에서 수술중 MEP 신호의 호전을 보인 환자들에서 수술후 한 달째 더 좋은 기능적 회복과 재원기간 단축을 확인하였다. 하지만 수술후 6개월째에는 유의한 차이를 보이지 않았다고 보고하였다[53]. 한편, Akbari 등은 경추 압박성 척수증환자 28명을 대상으로 진행한 연구에서 MEP 신호호전이 관찰된 군에서 그렇지 않은 환자군에 비해서 수술후 6개월째 우월한 기능회복을 확인하였으며, IONM이 감압 수술을 시행한 환자들의 신경학적 회복을 예측하는 유용한 도구라고 보고하였다[54]. 이렇게 IONM의 예후 예측 및 치료적 가치에 대해서 긍정적인 연구결과들이 보고되었지만, 아직 연구대상 질환의 종류가 한정적이며, 충분한 근거가 확보되었다고 할 수 없어, 앞으로 다양한 병변 및 질환에 대한 추가적인 연구가 필요하겠다.
결론
수술 중 신경계 감시 장치는 고위험 척추 수술에서 신경학적 합병증 발생을 예방하고, 신경학적 안전성을 향상시키는데 있어 매우 유용한 수단이 되었다. 즉, 수술 과정 중에 발생할 수 있는 신경 조직의 이상을 조기 감지하여 적절한 중재를 통해서 신경 손상이 비가역적으로 진행하는 것을 막을 수 있도록 돕는 것이다. 아울러 수술 술기 중 신경학적 합병증이 발생할 수 있는 과정을 더욱 잘 이해하게 되면서 보다 안전하고 적극적인 외과적 술기를 발전시키는데 큰 도움을 받을 것으로 기대된다. 그러나 감시법의 적용 기준 및 비용 효율성에 대한 추가적인 연구를 통하여 수술의 대상 질환 및 부위에 따라서 세분화된 기준을 적용할 수 있도록 발전시켜 나아가야 할 것이다.







