서론
뇌전증 환자에서 수술적 절제를 고려할 때, 절제 범위 내에 특정 기능과 관련된 부분이 포함될 때 영구적인 신경학적 결손의 위험이 있다. 그러므로 수술적 절제 시행 전에 절제할 뇌 주위의 기능을 평가하는 기능적 뇌지도화(functional brain mapping)가 필수적이다.
최근 기능적 자기 공명 영상(functional magnetic resonance imaging, fMRI)이나 확산텐서영상(diffusion tensor imaging, DTI)과 같은 신경영상검사의 발전에도 불구하고 여전히 전기자극매핑(electrical stimulation mapping, ESM)이 피질 기능을 확인하는 핵심적인 방법으로 여겨진다. 뇌전증 환자의 수술 전 뇌지도화를 위해서 전기자극매핑(ESM)을 이용하는데, 이를 위해서는 개두술(craniotomy) 후 두개강 내에 격자전극(grid electrode)과 선형전극(strip electrode) 등을 적절히 삽입한 후, 해당 전극에 자극을 주어 운동, 감각 및 언어 기능을 담당하는 뇌부위영역을 확인한다. 기존의 고전적인 전기자극매핑(ESM)은 50–60 Hz의 고주파, 정전류 자극, 역치 이상 강도 자극을 준 뒤, 임상적으로 기능 이상이 발견되는 부위를 찾아냈다. 하지만 이러한 방법은 시간이 많이 걸리고, 검사 중 발작의 유발 가능성 때문에 자극 강도를 올리는 데 제한이 있을 수 있고, 환자의 협조가 되지 않으면 정확한 뇌지도화가 어렵다는 단점이 있다[1].
최근에는 두개강 내 전극을 설치한 후 역치하(subthreshold)의 강도와 1 Hz 저주파자극(low frequency stimulation)을 가하여 임상적 반응 없이 파형의 변화를 기록하는 단일펄스 전기자극(single pulse electrical stimulation, SPES)을 이용한 기능적 뇌네트워크 평가방법이 이용되고 있다. SPES 자극을 20–50회 정도 반복 후 평균화하여 유발전위를 기록할 수 있는데, 이를 피질유발전위(cortico-cortical evoked potentials, CCEP)라고 한다[2]. 이 방법은 고전적인 전기자극매핑(ESM)에 비해 시간 소모가 적고, 환자의 협조도 덜 필요하며, 발작 유발 가능성도 낮다.
CCEP는 정상 연결에서 자극 후 초기파형으로 10–30 ms에서 나타나는 N1 파형과, 후기 파형으로 80–250 ms에서 나타나는 N2 파형으로 구성된다[3,4]. 초기 N1과 후기 N2 파형은 자극 부위와 기록 부위 사이의 유효연결(effective connection) 강도에 비례한다[5]. 병적인 연결에서 자극 후 200–1,000 ms 사이에서 지연반응(delayed response)이 관찰될 수도 있는데, 이것은 뇌전증발생부위와 같이 병적으로 흥분도(excitability)가 변화된 영역에서 관찰된다[3].
Matsumoto 등이 뇌전증 환자들을 대상으로 CCEP를 이용해 인간 언어 체계(human language system)의 기능적 연결(functional connectivity)을 확인하였고[4], 이후로 기능적 뇌지도화를 위해 CCEP를 사용하고 있으며[6], 수술장내에서도 수술 중 감시 방법으로 CCEP를 사용하는 보고도 있다[7]. 그러나 뇌전증 수술에서 CCEP의 이용은 아직 제한적이다.
따라서 본 증례에서는 뇌전증 수술을 위해 경막하전극(subdural electrodes)을 이용한 침습적 모니터링(invasive monitoring)을 시행한 측두엽 뇌전증 환자에서 CCEP를 이용하여 언어 체계의 연결성을 연구하여 뇌전증 수술에서의 유용성을 확인하고자 하였다.
증례
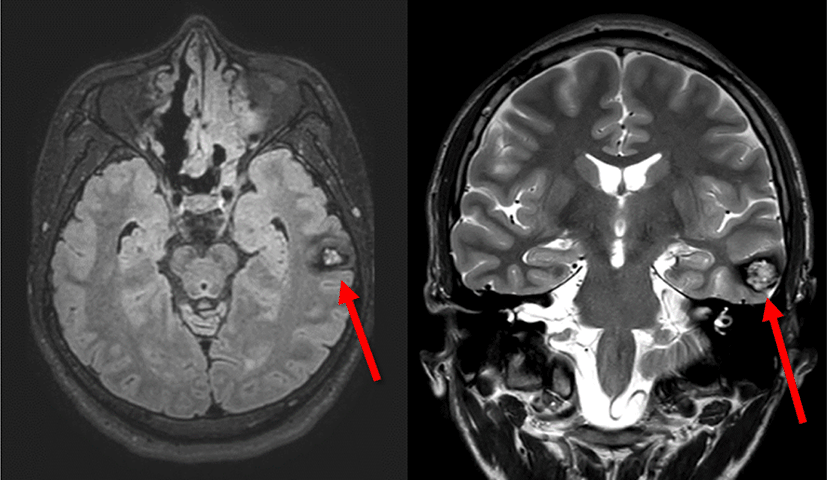
남자 29세 환자가 16세부터 시작된 복합부분발작이 항뇌전증약물 복합요법을 시행하였음에도 불구하고 주 1–2회 빈도로 발작이 지속되어 이에 대한 수술적 치료를 위해 본원 신경과에 입원하였다. 뇌 MRI에서 좌측 중간부터 아래관자이랑(Lt. middle to inferior temporal gyrus)에 해면상혈관기형(cavernous malformation)이 확인되었고, 비디오-뇌파 추적감시 결과 상기 병변에 의한 좌측 내외측두엽뇌전증(left mediolateral temporal lobe epilepsy)으로 진단되었다. 발작이 시작하는 부위가 우성 반구의 위측관자이랑(superior temporal gyrus)에 가까이 위치하고 있어, 언어영역(language area)을 피하면서 뇌절제 범위를 결정하기 위해 피질하전극(subdural electrode)과 심부전극(depth electrode)을 이용한 침습적 검사(invasive study)를 시행하였다. 환자는 개두술(craniectomy) 후 선형전극(strip electrode)과 격자전극(grid electrode)을 삽입한 후 일주일에 걸쳐 수술장외 피질뇌파검사(electrocorticography, ECoG)를 통해 뇌전증 발생 부위를 국소화하고 뇌기능 영역 평가를 시행한 후 뇌절제범위를 결정하였다.
검사는 엑셀텍(Xltek Protektor 32, Natus Medical, Middleton, WI, USA) 장비를 이용해 시행하였고, 유발전위검사로 CCEP와 함께 청각유발전위(middle latency auditory evoked potentials, MLAEP) 그리고 시각유발전위(visual evoked potentials, VEP)를 시행하였다.
CCEP에서 자극은 단일펄스전기자극(single-pulse electric stimulations)으로 극성은 교류 항전류성파(constant- current wave of alternating polarity), 펄스의 폭은 0.3 msec, 빈도는 1 Hz, 횟수는 25회를 가하였다. 자극 부위는 양극성(bipolar fashion)으로 인접한 전극 쌍(electrode pair)에 전달하였다. 자극 강도는 10–15 mA로 설정하였다. 기록은 저주파수 30 Hz, 고주파수 1,000 Hz, 디지털 데이터 추출율(sampling rate)은 60 kHz로 설정하였다.
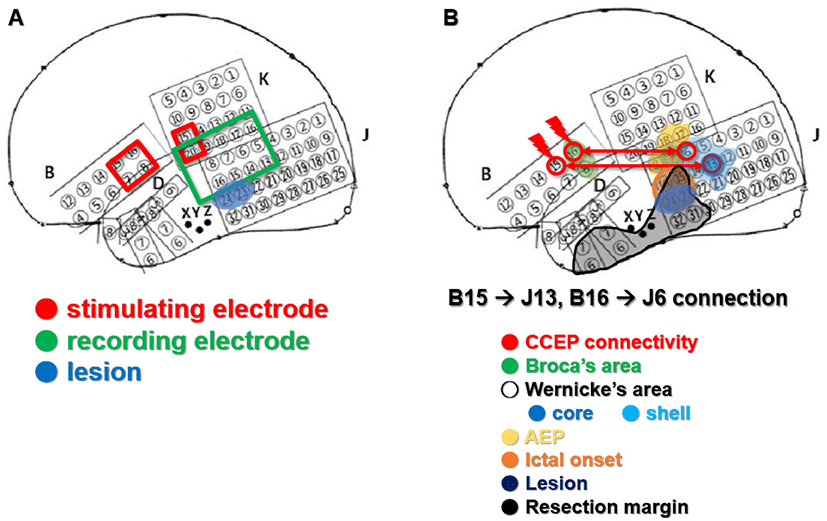
뇌피질의 해부학적 구조로 브로카영역(Broca’s area)의 가능성이 높은 위치의 전극쌍(B14/6, B15/7, B16/8, K15/20)을 자극하였을 때 가측 측두엽 부위(lateral temporal area)에서 CCEP를 확인하여 베르니케영역(Wernicke’s area)을 찾고자 하였다(Fig. 2).
고전적인 방식의 ESM은 이상(biphasic)의 항정전류 자극으로 50 Hz 자극을 후방전(afterdischarge)이 보이거나, 양성반응이 나타날 때까지 혹은 최대 15 mA까지 가하였다.
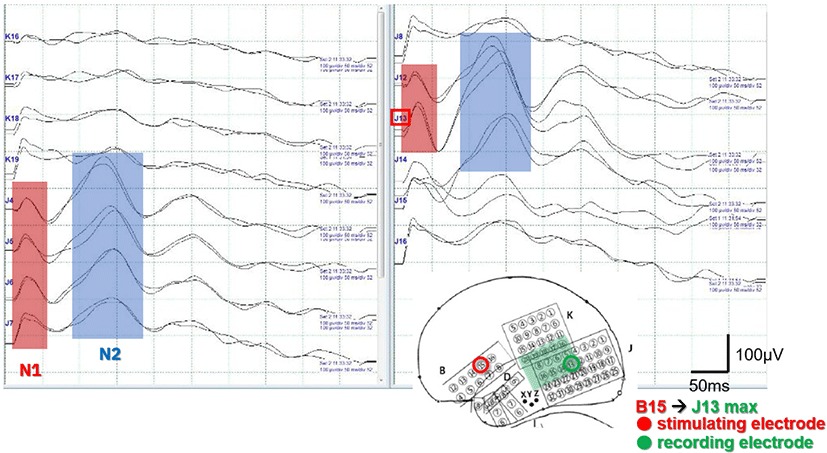
B15/7 전극쌍을 자극하였을 때, J13, J4–7, J12에서 초기 N1과 후기 N2 파형이 확인되었고, J13 전극에서 CCEP가 가장 크게 관찰되었다(Fig. 3). B16/8 전극쌍을 자극하였을 때 J6, J4, J5, J7, J13에서 N1, N2 파형이 확인되었고, J6에서 CCEP가 가장 크게 관찰되었다. 그러나 지연반응은 나타나지 않았다.
ESM을 이용한 기능적 뇌지도화에서 베르니케영역(Wernicke’s area)의 중심 부위(core region)로 확인된 부분은 J7, J13이었고, 베르니케영역(shell Wernicke’s area)의 주변 부위(shell region)로 확인된 부분은 J5, J6, J8, J12, J14, J21이었다.
MLAEP 검사에서는 J7, J8에서 P50 파형의 중간지연반응(middle latency response)이 확인되었다.
CCEP에서 가장 큰 파형이 관찰된 J13 및 J6 전극은 고전적인 뇌지도화에서 각각 베르니케영역의 중심부 및 외측부로 확인되어, 두 검사 결과가 일치함을 확인할 수 있었다.
발작간뇌파(interictal EEG)에서 병변주위극파(perilesional spike)가 가장 흔하게 관찰되었으며(J15,24 > J16,23), 발작중뇌파(Ictal EEG)는 모두 병변 주위에서 발생하였다(perilesional onset)(J15,23,24). 따라서, 해면상 혈관기형에 의한 좌측 내외측두엽뇌전증(mesio-lateral temporal lobe epilepsy)으로 진단하였다. 발작이 시작하는 부위가 우성 반구의 위측관자이랑(superior temporal gyrus)에 가까이 위치하여 절제 시 언어 기능을 담당하는 영역을 최대한 건드리지 않는 것이 중요한데, CCEP와 고전적 뇌지도화 결과를 바탕으로 언어기능 영역에 해당하는 부위는 포함하지 않도록 절제 범위를 결정하였다.
해면상 혈관기형(cavernous malformation) 병변을 모두 포함하여 병변절제술(lesionectomy) 및 부분 해마-편도절제술과 함께 CCEP에서 확인된 부위를 보존하면서 외측 측두엽의 확장절제술(extended resection)을 시행하였다.
병변은 병리학적으로 국소적 석회화(focal calcification)를 동반한 해면상혈관종(cavernous angioma)이었다. 추가적으로 가측측두엽피질(lateral temporal cortex)의 IIIb형 뇌피질이형성증(focal cortical dysplasia)이 확인되었다. 수술 후 환자는 언어 기능의 장애는 없었으며 추가적인 뇌전증 발작은 관찰되지 않았다.
고찰
저자들은 본 증례에서 CCEP를 통해 언어 체계(language system)의 뇌내연결(connection)을 확인하였고, 이것이 고전적인 ESM 결과와 일치함을 확인하였다. 그리고 수술적 절제 범위에서 이 부분을 제외함으로써, 수술 후 언어장애를 피할 수 있었다. 기능적 뇌지도화는 뇌전증 수술에서뿐만 아니라, 언어, 운동기능 등의 주요 뇌기능 부위를 침범하는 종양 등 제거술의 경우에서도 광범위하게 이용되고 있다. DTI, fMRI, 양전자단층촬영(positron emission tomography, PET), ECoG, 뇌자도(magnetoencephalography, MEG) 등의 다양한 검사 방법이 기능적 뇌지도화를 위해 사용되고 있다. 최근, 뇌기능에 대한 개념이 역동적 기능적 네트워크(dynamic functional networks) 개념으로 변화하면서 기능적 네트워크(functional network)를 확인하는 방법에 대한 연구가 늘어나고 있다. 그 중 CCEP는 뇌피질을 직접 자극함으로써 기능적 네트워크를 시각화할 수 있다. CCEP를 이용해 확인된 연결성 패턴(connectivity pattern)은 기존의 기능적 자기공명영상(fMRI)을 이용한 결과와 높은 일치율을 보였으며[3,8] 추가적으로 방향적(directional) 및 인과적(causal) 연결에 대한 정보도 제공할 수 있음이 확인되었다. 따라서 CCEP는 뇌 기능을 평가하고, 영역 간의 연결 정도(degree of connectivity)를 추론하고, 뇌전증 발생 영역을 정의하는 데도 사용할 수 있다.
CCEP는 자극 후 잡파가 관찰되는 10 ms 이내의 구간을 지나 10–30 ms 구간에서 예파 형태의 N1 파형이 나타나며 그 후 80–250 ms 구간에서 서파 형태의 고진폭의 N2 파형이 관찰될 수 있다. 초기 N1 성분은 깊은 피질층에 있는 피라미드 세포의 탈분극을 반영하며, DTI에서 관찰되는 경로와 같이 기본적인 해부학적 구조를 반영한다. N1 진폭은 연결된 백질섬유(white matter fibers)의 수와 양적 상관관계가 있어 두 영역 사이의 해부학적 연결(anatomic connectivity)의 강도를 시사한다. 반면, N2는 다양한 억제 과정을 거치면서 나타나는 파형으로, 더 오래 지속되고 느린 억제반응(longer lasting and slow inhibition)을 시사하며, 기능적 연결(functional connection)을 반영한다[4].
CCEP 연구들은 언어, 인지, 청각 및 시각 시스템뿐만 아니라 전두엽, 변연계(limbic system) 및 반구 간 연결(interhemispheric connection)을 포함한 다양한 피질 네트워크를 보여주었다.
뇌전증에서 CCEP 분석은 발작 유발 부위의 국소화에 대한 추가 단서를 제공하여 절제할 영역의 범위를 결정하는 데 사용할 수 있다[3]. 생리적 영역의 CCEP는 자극 200 ms 이내에 N1 및 N2 반응으로 나타나지만, 뇌전증 발생 영역과 같은 병적 부위에서는 자극 후 200–1,000 ms에서 극파 혹은 예파 형상을 보이는 후방전(after-discharge, AD)이 관찰될 수 있으며, 이러한 후방전이 보이는 영역을 절제하지 않으면 수술 결과가 나쁠 수 있다[3]. CCEP 측정과 ECoG를 결합하면 보다 포괄적인 정보를 얻을 수 있고, 뇌전증 발생 영역을 보다 정확하게 국소화하는 데 도움이 될 수 있다.
Yamao 등은 수술장 내에서 CCEP 감시를 통해 브로카영역과 베르니케영역의 연결을 확인하였고, 수술 중 전신마취 하에서 지속적인 CCEP의 감시가 수술 후의 기능 장애를 예측할 수 있음을 제시하였다[7]. 또한 N1파 진폭의 50% 감소가 영구적인 언어 장애를 예측할 수 있는 절단값(cutoff value)이 될 수 있음을 제시하였다[9]. 수술장에서 CCEP 추적 감시를 시행하여 수술 중 환자를 깨워서 직접 기능을 확인하지 않고 언어중추의 연결성을 확인하며 손상을 최소화하여 수술 후 언어장애 후유증을 예방할 수 있다.
CCEP의 한계는 전극이 커버할 수 있는 공간이 제한된다는 것이다. 예를 들어, 뇌궁(fornix), 시상하부(hypothalamus) 및 뇌간(brainstem)과 같은 피질하구조를 평가하기는 어렵다. 이러한 공간적 한계는 MEG, fMRI 및 PET과 같은 다른 영상기술로 보완될 수 있다. 또한, CCEP는 시행하는 센터마다 설정이 일치하지는 않기 때문에 결과에 대한 센터 간 비교가 어렵다. 이러한 한계점에도 CCEP는 수술장 내 및 수술장 외에서 뇌기능을 감시할 수 있으며, 뇌의 해부학적 연결성과 기능적 역동성(dynamics)을 파악하는 데 도움이 되며, 뇌 영역 간의 인과적 관계를 확인할 수 있는 유용한 도구이다. CCEP는 향후 효과적인 치료적신경조정술(therapeutic neuromodulation)의 근간이 될 수 있다.
본 연구에서는 뇌전증에서 우성반구의 외측두엽에 위치하여 정확한 언어적 기능 평가가 필요했던 환자에서 CCEP를 이용한 language mapping을 고도화하여 성공적으로 뇌전증수술을 시행한 것을 국내 첫 연구로 보고한다. 이러한 결과는 향후 CCEP도 뇌전증 수술에서 정교한 뇌기능 지도화가 필요한 경우에 효과적으로 이용될 수 있다는 것을 뒷받침한다.







