서론
척추 수술에서 수술중신경계감시(intraoperative neurophysiologic monitoring, IONM)의 유용성은 잘 알려져 있다[1]. 특히 척수종양에서의 IONM은 수술 중 신경 손상 또는 허혈성 손상을 조기에 발견하고 수술 후 신경학적 악화를 예방하기 위해 널리 사용되고 있으며[2], 그 민감도와 특이도 또한 높다고 알려져 있다[3]. 특히 척수종양 수술에서 운동유발전위(motor evoked potentials, MEPs)는 체성감각유발전위(somatosensory evoked potentials, SEPs)보다 수술 후 운동 악화(post-operative motor deterioration)에 대한 특이도가 높다고 알려져 있으며[4], 통상적으로 MEP는 전경골근(tibialis anterior), 엄지발가락 벌림근(abductor halluces) 등을 이용하여 측정한다[5]. 하지만 통상적인 방법으로는 흉추-요추 1번 사이의 상위운동신경원(upper motor neuron)은 감시가 가능하지만, 흉추-요추 1번 사이에서 직접 나오는 하위운동신경원(lower motor neuron)의 감시는 불가능하다는 단점이 있다. 하위 흉추의 하위운동신경원에 대한 신경생리학적 검사로 흉추 척추근(thoracic paraspinalis) 혹은 복직근(rectus abdominis muscle)을 이용한 침근전도 검사가 진단에 도움이 될 수 있다고 알려져 있다[6]. 하지만 이를 적용한 수술중감시는 보고된 바가 없다. 이에 12번 흉추 – 1번 요추 사이에 위치한 신경초종(schawannoma) 환자에서 복직근을 이용한 수술중감시를 성공적으로 시행한 증례를 보고하고자 한다.
증례
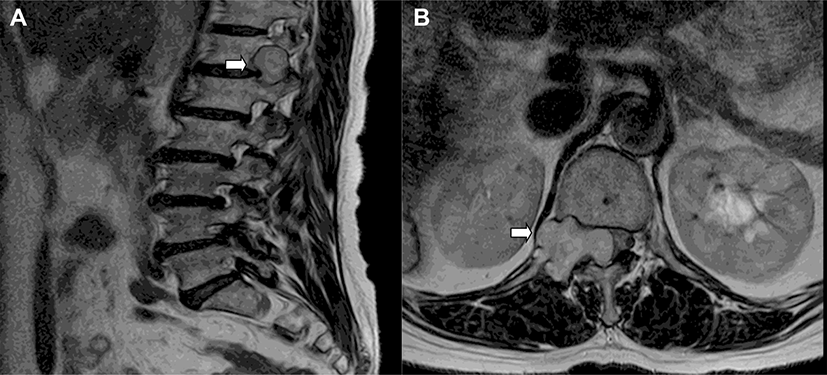
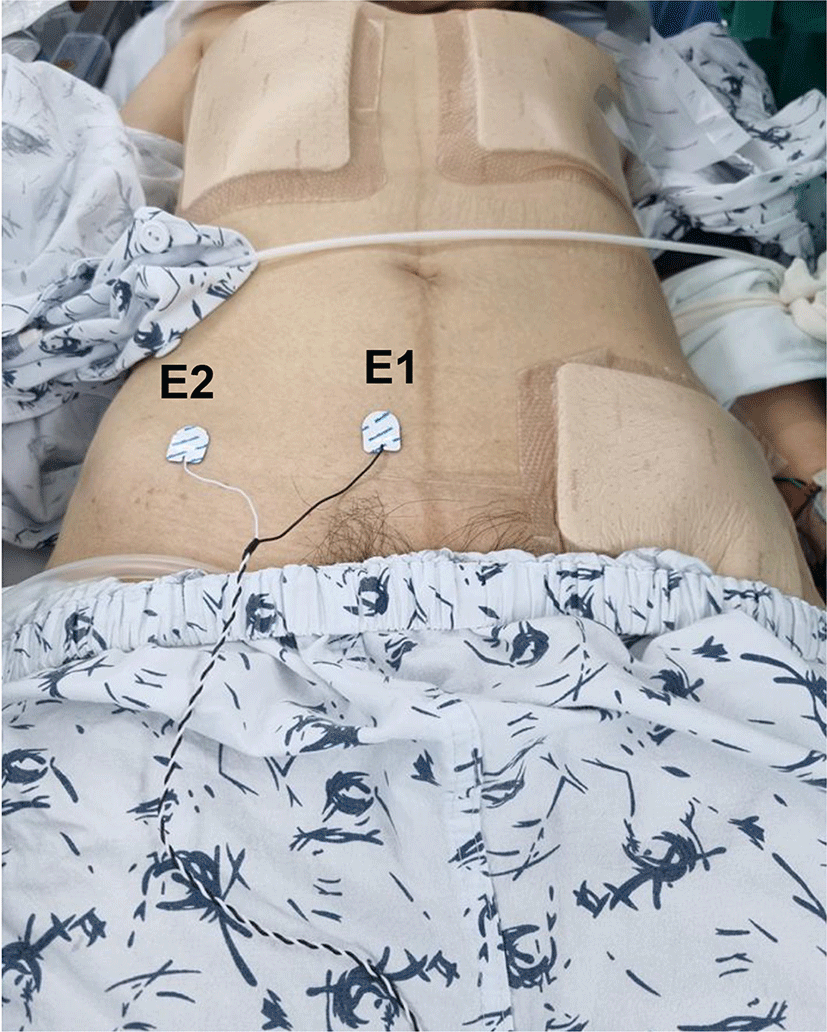
69세 여자 환자가 요통 및 양측 하지의 방사통을 주소로 본원 내원하여 시행한 요추 자기공명 영상 결과, 12번 흉추 – 1번 요추 사이에 경막외 종양(3.2 × 2.3 × 2.9 cm; Fig. 1)이 확인되었으며 신경초종 의증으로 제거 수술을 시행하였다. 환자는 고혈압 외 특이 병력 없었으며 요통, 양측 하지 방사통, 우측 대퇴 근위부와 사타구니 부근에 통증 호소하였다. 이학적 검사상 양측 발목 아래로 감각 저하 있었고, 근력은 도수 근력 검사상(총 5점) 양측 상하지 근력 모두 5점이었으나 주관적으로 양하지 위약감이 있었다. 주관적인 복근 근력의 위약감은 없었으며, T12 신경의 피부분절(dermatome)에 통증은 명확하지 않았고 감각 저하는 없었다. 심부건 반사는 양측 모두 정상 범위이며, 호프만 사인, 바빈스키 검사, 항문근 조임 검사도 모두 정상 범위였다. 독립적으로 보행 가능하였으며 대변, 소변 기능은 정상이었다. 수술 전 신경생리검사는 시행하지 않았다. 수술은 복와위 자세에서 후방접근술로 진행되었고, 마취는 프로포폴(propofol)과 레미펜타닐(remifentanil)을 사용하여 완전정맥마취(total intravenous anesthesia)로 진행하였다. 기관 내 삽관을 위한 근이완제는 로큐메론(rocumeron) 40 mg을 1회 정맥주사하였고, 이후 수술 종료 시까지 투여하지 않았다. 수술중신경계 감시는 NIM-ECLIPSE System® 4 (Medtronic Xomed, Jacksonville, FL, USA) 장비를 이용해 운동유발전위, 체성감각유발전위, 자발근전도(free-running electromyography)를 측정하였다. 복직근의 MEP는 복부에 표면 전극을 부착하여 측정하였다. 부착 부위는 위앞엉덩뼈가시(anterior superior iliac spine)와 평행하며 중간(midline)에 가까운 곳에 활성전극을 부착하였고, 활성전극과 평행하며 전방 겨드랑이 수직 라인과 만나는 곳에 참고 전극을 부착하였다(Fig. 2). 반대 측 복직근도 동일한 방법으로 표면 전극을 부착하여 양측을 비교 측정하였다.
MEP는 경두개 전기자극(transcranial electrical stimulation) 방식으로 C3’-C4’ 위치의 두피에 침 전극을 꽂고 통상 시행하는 양측 짧은 엄지 벌림근(abductor pollicis brevis), 전경골근(tibialis anterior), 내측광근(vastus medialis), 엄지 발가락 벌림근(abductor halluces) 이 외에 장내전근(adductor longus), 하부 복직근(lower rectus abdominis)을 측정하였다(300–450 Volt 자극 강도, 5회 반복 펄스, 50–75 us 지속 기간).
MEP 전극 기록 화면의 표시는 측정 속도(sweep speed)는 10.0 ms/division이었고, 감도(sensitivity)는 150 uV이었다. SEP는 양측 정중 신경(median nerve)과 경골 신경(tibial nerve)에서 자극을 가하는 통상의 방식으로 시행하였고 C3’, C4’, Cz’와 Fpz’에서 기록되었다(정중 신경 자극 강도 20 mA, 경골 신경 자극강도 25 mA, 4.91 Hz 자극 빈도).
신경생리학적 경보(alarm) 신호는 MEP의 진폭이 기준파형(baseline)의 50% 이상 감소하는 경우로 정의하였고, SEP는 기준파형에 비해 진폭이 50% 이상 감소하거나 잠복기가 10% 이상 연장되는 경우로 정의하였다. 자발근전도는 MEP와 동일한 근육에서 측정하였고 지속적이고 반복적인 신경 긴장성 신호(neurotonic discharge)가 관찰되는 경우를 임상적 의미가 있는 것으로 보았다. 수술 중 후궁 절제술 이후 종양이 노출되었으며, 종양은 T12 신경의 잔뿌리(rootlet)와 뿌리(root)를 구분하기 어렵게 신경을 누르고 있었다. 종양의 전절제(total resection)를 위해서는 T12 신경의 절제가 불가피하여, 신경 잔뿌리-뿌리 부근에서 T12 신경 절제도 함께 진행되었다.
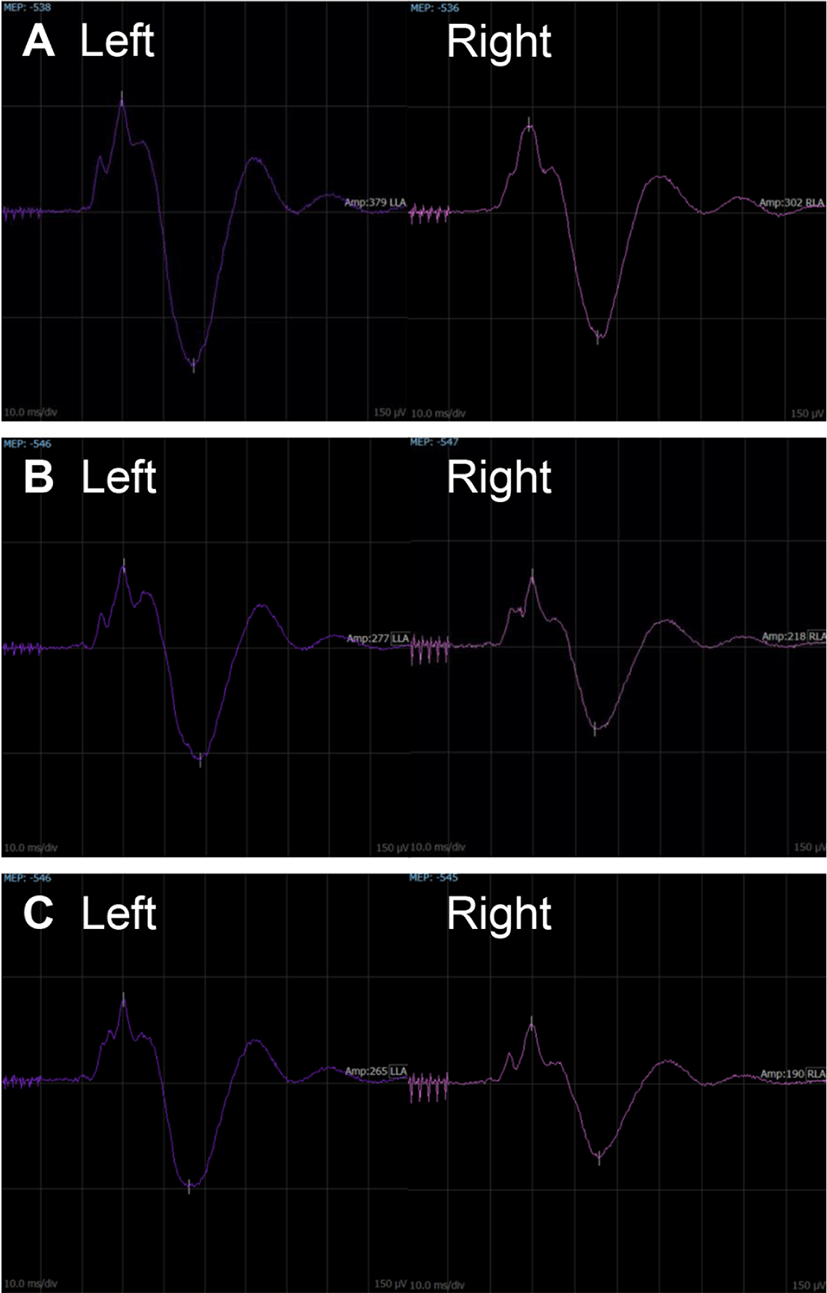
수술 시작 시에 우측 복직근에서 기록된 MEP 파형은 기시잠시 21.4 ms, 진폭은 302 uV였으며, 좌측 복직근에서는 기시잠시 21.0 ms, 진폭은 379 uV였다(Fig. 3-A). 수술 중간에 종양을 제거한 시점에 우측 복직근에서 기록된 MEP의 기시잠시는 21.8 ms, 진폭은 218 uV였으며, 좌측 복직근에서는 기시잠시는 21.0 ms, 진폭은 277 uV였다(Fig. 3-B). 모든 수술 시간 동안 운동전위는 비교적 일정한 파형을 보였고, 50% 이상의 진폭의 감소는 관찰되지 않았다. 수술 종료 시 우측 복직근에서 기록된 MEP의 기시잠시는 21.4 ms, 진폭은 190 uV였으며, 좌측 복직근에서는 잠시는 21.6 ms, 진폭은 265 uV였다(Fig. 3-C).
SEP에서도 양측 정중신경 N20과 후경골신경 P37 파형의 유의미한 변화는 없었다. 자발근전도의 경우, 특히 종양 제거 시에 신경 긴장성 신호가 간간이 관찰되었지만, 당시 50% 이상의 MEP의 감소는 없었다. 수술 후 양하지 근력 저하는 없었으며, 주관적인 복근 근력 저하 또한 없었다. 더불어 대변, 소변 기능도 정상이었다. 수술 한 달 후 요통, 방사통, 사타구니 부근 통증은 어느 정도 호전되었으며, 주관적인 양하지 위약감도 호전되었다고 보고하였다. 복근 근력은 수술 전과 비슷하다고 보고하였고, T12 신경의 피부 분절에 감각 저하나 통증은 없었다.
고찰
본 증례는 12번 흉추–1번 요추 사이에 위치한 신경초종 환자에서 복직근을 이용한 수술 중 자발근전도 및 MEP 감시에 대한 증례를 보고하고자 하였다.
척추 종양은 척수 신경근(spinal nerve root)을 누르거나, 척추 신경공(neural foramen)에 위치한 경우 신경근병증(radiculopathy) 증상을 발생시킬 수 있으며[7], 이 경우 수술 중 신경 손상의 가능성이 높아질 수 있다. 한 연구에 따르면, 신경초종의 경우 수술 후 15%에서 새로운 감각 증상이 발생하였고 5%에서 이전에 없던 운동 증상이 발생하였다고 보고하였다[8]. 본 증례에서는 척추 신경공을 통해 척추관 및 척추 주변 구성 요소와 소통하는 덤벨 종양(spinal dumbbell tumor)으로, 특히 이런 경우 수술장에서 후궁절제술 후 종양과 신경 뿌리가 바로 노출되기 때문에 수술 중 신경 감시의 필요성이 증대된다[9]. 뿐만 아니라 본 증례와 같이 종양과 함께 신경을 절제(sacrifice)해야 하는 경우도 많아 수술 중 신경계 감시의 필요성은 더욱 커진다. 하지만 통상적으로 사용하는 사지의 근육을 이용한 방법으로는 흉추 신경근의 손상을 확인하기 어렵다는 한계가 있다. 이러한 흉추 신경근의 손상은 흉추 척추근 혹은 복직근을 이용한 침근전도 검사가 도움이 될 수 있으며, 피부체성감각유발전위(dermatomal SEP) 또한 진단에 도움이 될 수 있다고 알려져 있지만[10], 수술중신경계감시의 적용을 한 예는 없었다. 본 증례에서는 엎드린 자세를 유지하며 후방 절개로 수술을 진행했기 때문에 흉추 척추근을 이용한 검사는 불가하였다. Dermatomal SEP의 수술중신경감시의 적용은 몇 가지 증례에서 그 유용성을 보고하기도 하였지만[11], 본 증례에서는 복직근을 이용한 MEP 및 자발근전도 감시만을 진행하였다. 추후 dermatomal SEP를 같이 적용한다면 민감도와 특이도를 더 높일 수 있을 것으로 사료된다.
본 증례는 종양의 제거를 위해 T12 신경의 절제가 불가피하였고 따라서 신경 절제 후 우측 복직근 MEP의 진폭 감소가 예상되었다. 실제로 종양 절제 후 우측 복직근에서의 MEP 진폭 감소가 관찰되었지만, 반대 측에서도 감소한 것을 고려했을 때 크게 유의미한 감소는 아니었으며 50% 이상의 감소도 보이지 않았다. 이후 수술 종료 시점까지 MEP의 진폭은 잘 유지되었다. 이렇듯 우측 T12 신경을 절제했음에도 우측 MEP 진폭의 감소가 상대적으로 크지 않았는데, 이는 두 가지로 설명할 수 있다.
첫째는, 종양 절제 전 양측 복직근에서 MEP의 진폭을 비교해 보면 우측이 좌측에 비해 감소되어 있는 것을 볼 수 있으며, 이는 이미 수술 전부터 우측 T12 신경 손상이 발생하여 기능이 없는(non-functional) 신경일 수 있음을 시사한다. 더불어 종양과 신경이 엉겨 붙은 수술장 소견도 이를 뒷받침한다. 이전 연구에서 MEP를 통해 신경 뿌리의 기능(function)을 볼 수 있다고 알려져 있고, non-functional 신경일 경우 functional 신경에 비해 좀 더 적극적인 수술 방법이 가능하며 절제 후에도 새로운 신경학적 증상 발생의 가능성은 낮다고 알려져 있다[12]. 이전 연구를 토대로 볼 때, T12 신경을 제거했음에도 MEP의 진폭이 크게 떨어지지 않고 새로운 증상이 발생하지 않은 이유를 non functional 신경으로 설명이 가능하다. 하지만 본 증례에서 우측 MEP의 진폭은 반대 측과 비교했을 때 50% 이상 차이가 나지 않았으며, non-function인 신경이라면 수술 전 T12 신경의 피부 분절에 따르는 통증 혹은 감각 저하가 있었을 수 있는데, 본 증례의 환자의 경우 해당 증상이 명확하지 않았던 점은 T12 신경을 non-function이라고 명확하게 말하기 어렵게 하는 요소이다.
둘째로는 본 증례의 제한점으로, 복직근은 T7-T12의 넓은 범위의 신경뿌리로부터 지배를 받기 때문에 하나의 신경뿌리로의 국소화(localization)가 쉽지 않으며 특히 MEP의 진폭은 각 신경뿌리의 합(summation)일 수 있으므로 증례에서 기록한 복직근의 MEP가 T12 하나의 신경뿌리를 대표하지 않을 수 있다. 따라서 T11-T12 신경뿌리의 경우 배꼽 하부(infra- umbilical) 부근을 지배한다고 알려져 있고[13], 늑골하신경(T12)의 해부학적 경로를 고려하여[14], 위앞엉덩뼈가시와 평행한 라인에서 MEP와 자발근전도를 측정함으로써 최대한의 국소화를 이끌어내고자 하였다. 하지만 여전히 오류의 가능성은 존재하며 향후 추가적인 연구가 필요할 것이다.
신경 뿌리의 손상 여부를 평가하는 데 자발근전도 검사는 매우 유용하며 민감도는 높으나 특이도는 낮다고 알려져 있다[15]. 본 증례에서도 종양 절제 시 높은 민감도로 간헐적인 신경 긴장성 신호가 보였지만 MEP에서 50% 이상 감소 소견은 관찰되지 않았다. 이는 본 증례와 같이 자발근전도 검사와 MEP 검사를 함께 보았을 때 특이도를 높일 수 있음을 보여준다.
이전 연구에서 수술중신경생리 검사의 결과에 따른 기능의 예후를 보고한 바 있으며[16], 본 증례도 T12 신경 절제 후에도 유지되는 MEP 결과를 고려했을 때, T12 신경 제거로 인한 복직근에 대한 기능적 예후는 좋을 것으로 예상되었다. 실제 환자는 수술 후 신경학적 부작용을 보고하지 않았으며 이는 수술 중 MEP의 결과가 수술 후 환자의 예후를 반영할 수 있음을 시사한다. 하지만 수술 전후로 복직근의 근력 평가를 객관적인 평가나 도구 없이 주관적인 환자의 문진으로만 시행되었다는 것은 본 증례의 제한점이다. 추후 double leg lowering test와 같은 복근 근력의 객관적인 평가 도구를 이용한 연구가 필요하겠다[17].
복직근을 이용한 MEP 및 자발근전도는 하지의 다른 근육과 비슷하게 일정한 파형을 보이며 감시 가능한 파형을 보였다. 이는 복직근을 이용한 신경계감시가 흉추 종양 수술에서 신경 손상 방지를 위해 사용될 수 있음을 시사한다. 하지만 유용성(usefulness)에 대해서는 향후 추가적인 연구를 통해 확인이 필요하다.







