서론
척수 해면상 혈관종(spinal cord cavernous angioma)은 전체 척수 혈관 기형(vascular malformation)의 5%–12%를 차지하는 비교적 드문 질환으로, 대다수의 경우 팔다리 근력저하, 이상감각, 대소변 조절 장애 등의 신경학적 증상을 유발하고, 출혈 시에는 급성 악화(acute deterioration)를 야기할 수도 있다[1]. 신경학적 결손이 발생하는 경우, 결국 수술적 제거를 선택하게 되는데, 다른 척수 수질내 종양(intramedullary tumor) 제거술과 마찬가지로, 제거 과정 자체가 추가적으로 신경 손상을 유발할 수 있다.
다양한 척추/척수 질환에서 운동유발전위(motor evoked potential, MEP), 체성감각유발전위(somatosensory evoked potential, SSEP), 자발/유발 근전도(free-running/triggered electromyography), 구해면체근반사(bulbocavernosus reflex, BCR), 및 척수 지도화(spinal cord mapping) 등의 여러 수술 중 신경계 감시(intraoperative neurophysiologic monitoring, IONM) 방법을 적용해 신경학적 손상을 실시간 감시하고, 수술 후 신경학적 예후를 예측하는 데 도움이 될 수 있다는 연구 결과들이 지난 수십년에 걸쳐 누적된 상태로[2,3], 척수 해면상 혈관종 수술도 기타 척수 수질내 종양 수술과 동일한 방법으로 적용이 가능하겠다. 하지만 상대적으로 드문 질환이라, 과거에는 일부 척수 해면상 혈관종 환자들을 포함시켜, 전체 척수 수질내 종양 그룹에서의 IONM 활용에 대한 연구 형태로 이뤄졌고[4], 독립적으로 척수 해면상 혈관종에서의 IONM 적용에 관한 연구는 최근에야 소규모 후향적 분석 연구 형태로 발표되었다[5]. 본 저자들은 척수 해면상 혈관종 환자의 좌우측 하지에서 서로 다른 패턴의 IONM 변화가 있었고, 그에 따라 수술 후 신경학적 증상도 좌우측 하지에 저명한 차이를 보였던 증례를 경험했는데, 임상에서 추구하고자 하는 IONM의 역할에 잘 부합한다고 판단되어 이를 보고하고자 한다.
증례
과거 기저 질환력이 없던 29세 남자가 약 1년 전부터 발생하여 지속되는 통증으로 병원을 방문하였다. 좌측 가슴부터 골반부위까지 칼로 찌르는 듯한 통증이 박동성으로 느껴진다고 하였고, 이와 함께 양측 하지로 쥐어짜는 듯한 통증과 함께, 오래 걷다 보면 양쪽 다리에 힘이 빠진다고 하였다. 요의는 느껴지지만, 이전과 다르게 잔뇨감이 남는다고 하였다. 내원 당시 신경계 검진에서, 양측 하지 원위부에 MRC 등급 4로 근력이 저하되었고, 양측에서 T4 레벨 이하로 통증과 함께 통각에 대한 감각 저하가 있었다. 양측의 무릎 및 발목의 건반사는 항진되어 있었다.
척수 MRI에서는 T5-6 레벨에서 약 3.5 cm 크기의 척수 수질내 병변이 보였고(popcorn appearance), T2-강조영상에서 저신호강도의 ‘띠(rim)’ 형태 및 T1-강조영상에서 고신호강도 병변이 섞여 있고, 경미한 조영증강이 동반되어 있어 영상학적으로는 척수 해면상 혈관종이 의심되었다(Fig. 1-A, 1-B, 1-C, and 1-D). 환자는 상기 소견에 대해 T4-T6 레벨에서 후궁절제술(laminectomy) 및 종양제거술을 계획하였다. 마취는 프로포폴(propofol) 3.3–4.8 μg/mL와 레미펜타닐(remifentanil) 0.5–2.5 μg/mL를 사용하여 완전정맥마취로 시행하였고, 근이완제인 로쿠로늄(rocuronium) 40 mg을 기관삽관시에만 1회 주사하였다. IONM은 Xltek protector 32 IOM system(Natus Medical, Oakville, Canada) 장비를 이용해, MEP, SSEP 및 BCR 감시를 시행하였다. MEP는 경두개 전기자극(transcranial electrical stimulation) 방식으로 국제 10–20 전극 배치법에 따라 좌우 중심구 주변 C1과 C2에 위치한 전극을 통해 자극하여 양측 짧은엄지벌림근(abductor pollicis brevis), 정강앞근육(tibialis anterior), 무지외전근(abductor hallucis)에서 기록하였다(250–280 V 자극강도, 5회 반복 펄스, 50 μs 펄스폭, 2–4 ms 자극간격). 유의미한 MEP의 경고 징후(warning sign)는 MEP 진폭이 기준파형(baseline) 대비 80% 이상 감소하는 경우로 정의하였다. SSEP는 양측 정중신경과 후경골신경을 자극하였고, Fz를 참고전극으로 하여 C3’, Cz’, C4’에서 기록하였다(15 mA 자극 강도[상지], 20–30 mA 자극 강도[하지], 0.3 ms 자극 길이, 2.31 Hz 자극 빈도). SSEP의 유의미한 경고 징후는 기준파형 대비 진폭이 50% 이상 감소하거나 잠복기가 10% 이상 늘어나는 경우로 정의하였다. BCR은 음경의 등쪽 기둥에 양극의 침전극을 위치시키고, 이보다 가측에 음극의 침전극을 위치시킨 후 음부신경(pudendal nerve)을 자극해 양측 외항문괄약근에서 파형을 기록하였다(65 mA 자극강도, 4회 반복 펄스, 0.1 ms 자극 길이, 500 Hz 자극 빈도). BCR에 대한 경고 징후 기준은 일측 또는 양측에서의 BCR의 소실로 정의하였다.
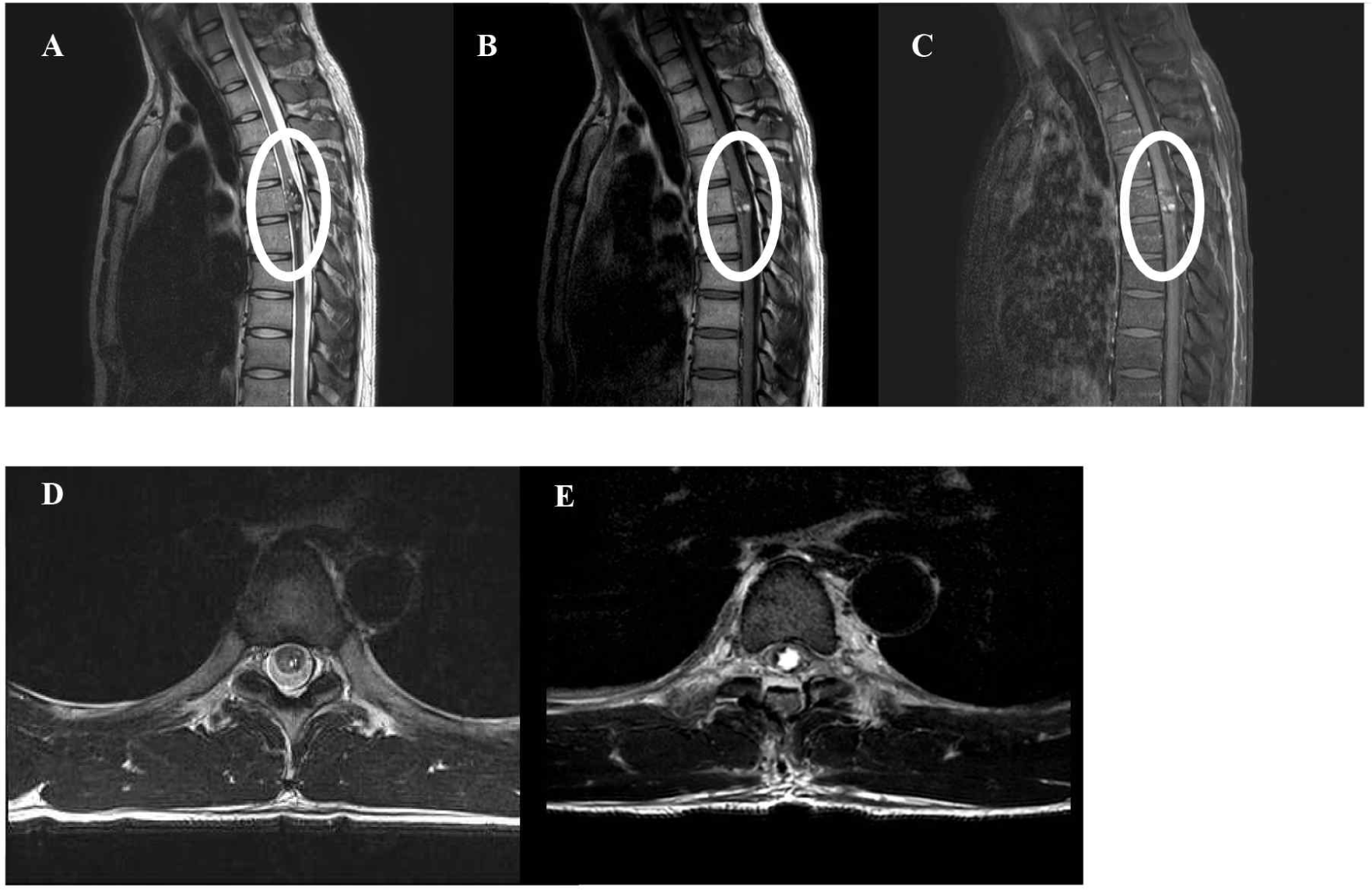
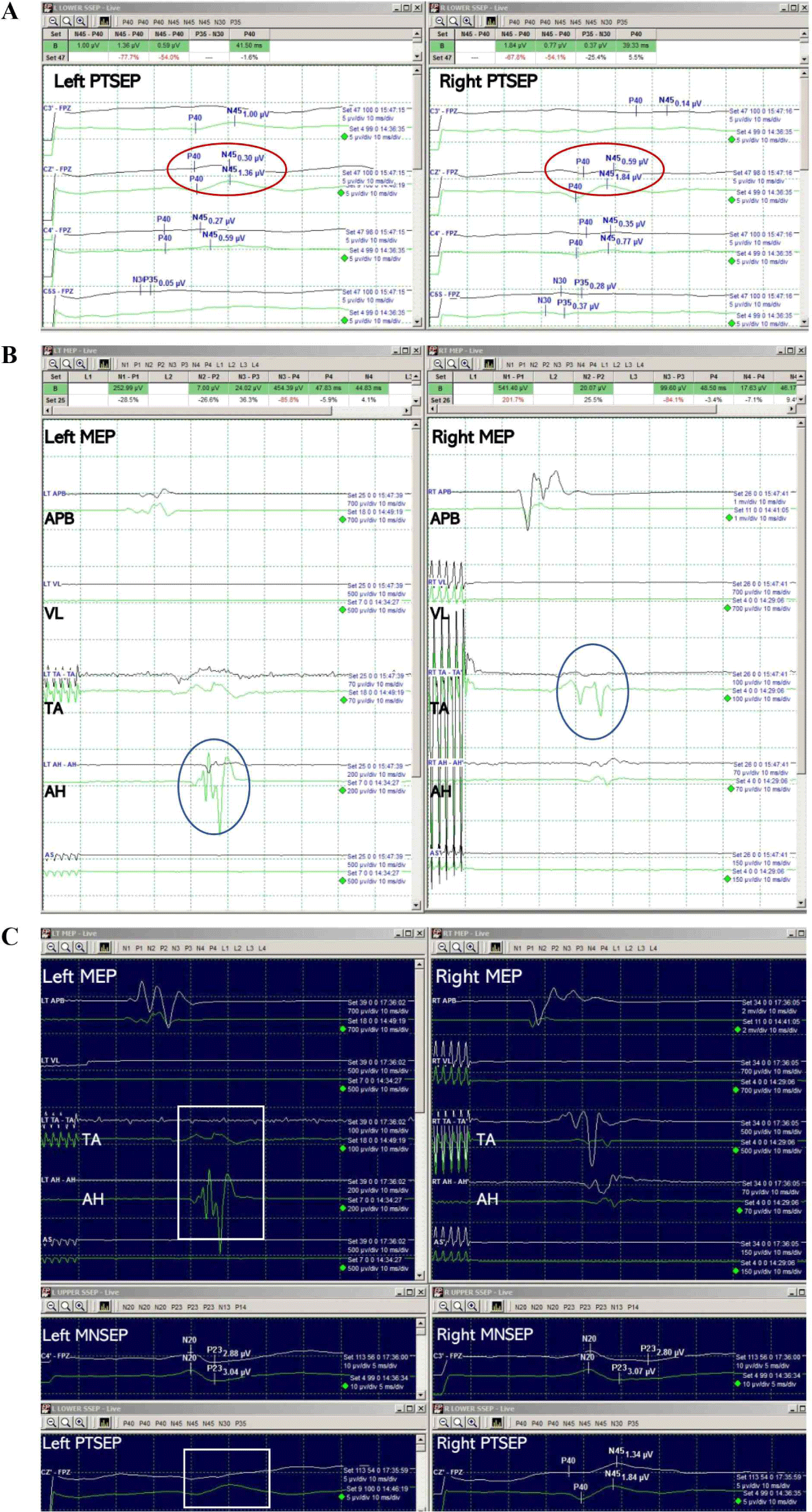
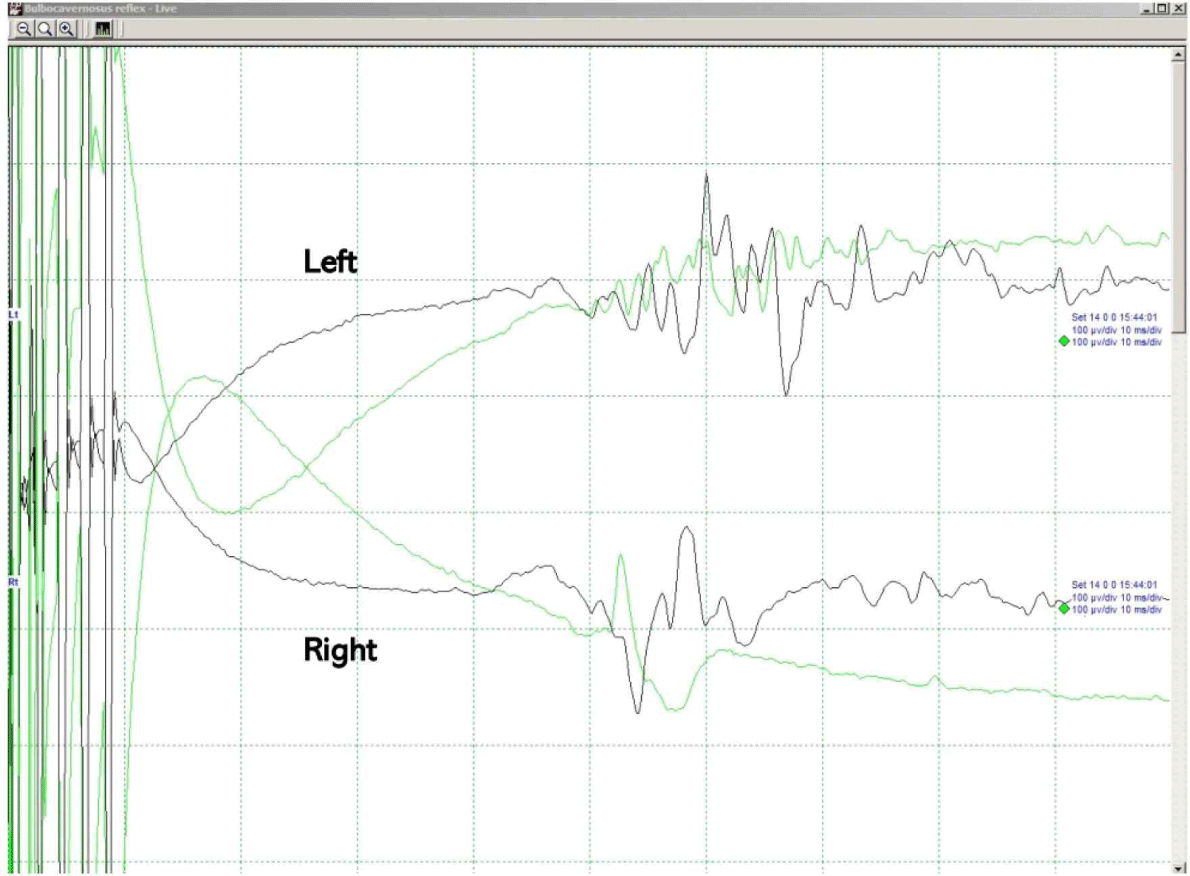
수술 시작 시, 양측 하지에서 모두 MEP와 SSEP는 성공적으로 기록되었으나, 척수절개술(myelotomy)을 시행하고 들어가 병변 박리를 시작한 지 얼마 지나지 않아, 양측 하지의 PTSEP에서 모두 기준 파형 대비 50% 이상 진폭이 감소하였고(Fig. 2-A), 우측 정강앞근육 및 좌측 무지외전근에서 유의미한 MEP 진폭 감소(기준 파형 대비 80% 감소)가 관찰되었다(Fig. 2-B). 이를 집도의에게 알렸고, 환자의 활력 징후의 유의미한 변화나 마취 심도 변화 및 기계적 문제 등의 가능성을 확인해봤으나, 특이 사항은 없었다. 또한 생리식염수 세척 및 견인기 견인력 재조정 등을 진행했으나 변화는 없었고, 아직 혈관종 제거 초기 단계라, 조심스럽게 수술을 진행하였다. 혈관종을 척수와 박리해 나가는 도중, 우측 하지의 PTSEP는 진폭이 회복되었고, 우측 정강앞근육의 MEP 또한 진폭이 모두 회복되었으나, 좌측의 경우는 오히려 좌측 정강앞근육과 무지외전근 MEP는 모두 소실되고, 좌측 PTSEP 또한 같이 소실된 채로 수술 마지막까지 유지되었다. 이 당시에도 마취 심도 변화나, 추가 약제 투약 등의 특이 사항은 없었고, 잠시 수술을 멈추고 견인기를 풀고, 생리식염수 세척을 시행했으나, 파형의 회복은 없었고, 혈관종 제거 과정에서의 신경로 손상으로 판단하였다. BCR의 경우는 수술 종료시까지 유의미한 신경생리학적 변화는 보이지 않았다(Fig. 3). 수술 직후 환자는 우측 하지의 근력 및 감각에는 문제가 없었으나, 좌측 하지 근력은 MRC Gr 1로 떨어졌고, 통각 및 고유감각 모두 좌측 하지에서 심하게 저하되었다. 수술 후, 촬영한 척수 MRI에서는 T5 레벨에서, 좌측으로 다소 치우친, 척수 조직 일부의 결손(defect)이 관찰되었다(Fig. 1E). 하지만 한달 후 외래진료에서 재평가했을 때는 좌측 하지 근력은 MRC Gr 4로 호전되었고, 감각 저하도 여전히 있었지만 수술 직후보다는 다소 호전된 상태였으나, 해당 증상들은 수술 후 1년 추적관찰 시기에도 지속됨이 확인되었다. 배뇨 증상의 경우는, 수술 전 잔뇨감이 있는 상태였으나, 수술 후에는 호전되어, 특별히 호소하는 배뇨 증상은 없었다.
고찰
척수 해면상 혈관종은 상대적으로 드문 질환으로, 일부는 우연히 척수 MRI 등의 검사를 통해 발견되는 경우가 있으나, 대부분은 다양한 신경학적 증상의 발현을 계기로 진단되게 된다. 척수 해면상 혈관종의 임상 경과에 대한 가장 큰 규모의 최근 메타분석 결과에 따르면[1], 혈관종의 위치는 흉추(55.2%), 경추(38%), 경흉추(2.4%) 순이었고, 16.5%의 환자에서는 대뇌 해면상 혈관종이 동반되어 있었다. 신경학적 증상으로는 사지 위약이 60.5%로 가장 흔한 증상이었고, 그 뒤를 감각저하(57.8%), 통증(33.8%), 대소변 장애(23.6%)가 뒤를 이었다. 무증상 환자는 1% 정도로 매우 드물었다. 약 90%의 환자들이 결국 수술적 절제를 받게 되고, 나머지 환자들이 보존적 치료를 받았는데, 수술을 받은 환자들의 예후가 보존적 치료를 받은 환자들보다 좋은 것으로 나타났다(OR 2.79, 95% CI; 1.46–5.33, p = 0.002). 특히 증상 발현 후 3개월 이내에 수술적 절제를 시행했을 경우와 전체 절제술(gross-total resection)을 시행했을 경우가 신경학적 예후의 향상과 상관관계가 있었다. 척수 해면상 혈관종의 ‘연간 출혈 위험도(annualized bleeding risk)’는 여러 케이스 시리즈 연구마다 다소 차이는 있으나, 대략 2%–5.5% 정도로 보고되어 있다. 상당히 높은 비율의 환자에서 수술적 치료를 받게 되기 때문에, 수술과정과 관련해 환자의 수술 후 신경학적 예후가 어떨지가 IONM의 적용의 효용성에 대해 판단하는 데 도움이 될 수 있겠다.
척수 해면상 혈관종의 경우 수질내 종양의 한 그룹으로 생각할 수 있기 때문에, 수질내 종양제거술에서의 IONM의 활용에 대한 선행 연구들을 살펴보면, 간접적으로 임상적 의미에 대한 파악이 가능할 것이다. 다양한 연구 그룹에서 척수 수질내 종양제거술에서 IONM의 활용에 대해 환자군 연구/코호트 연구 형태로 발표했는데[6], 대부분 연구에서 MEP(+D-파형) 혹은 ‘MEP + SSEP’의 적용이 수술 후 환자의 신경학적 결손을 예측하는 데 있어 상당한 수준의 민감도/특이도를 가지는 것으로 밝혀졌다. 초기에 이뤄졌던 대표적인 연구를 간단히 살펴보면, Kothbauer 그룹은 100명의 척수 수질내 종양환자들(이 중 3명이 해면상 혈관종)의 수술에서 MEP 및 D-파형 감시를 시행해 수술 후 신경학적 단기 예후와 연관성을 분석했는데[4], MEP는 완전히 비가역적 소실을 보이는 경우, D-파형은 50% 이상의 진폭 감시를 보이는 경우를 유의미한 변화로 정의했을 때, 수술 후 위약 발생을 예측함에 있어 100% 민감도 및 91% 특이도를 가지는 것으로 발표되었다. 여러 윤리적인 문제로 IONM 영역에서는 무작위 배정(randomized controlled) 임상연구가 불가능하기 때문에, 과거에 IONM을 시행하지 않고 수술했던 환자군들과의 간접 비교를 시행하는 연구 형태(historical-control group)를 간혹 사용하는데, 2009년 Sala 그룹은 IONM을 적용하기 전의 척수 수질내 종양제거술을 받은 환자 50명과, 동일한 수술팀이 수술을 하되, IONM을 적용한 환자 50명을 비교 분석했다[7]. 해당 연구에서는
MEP는 완전 소실인 경우를, 그리고 D-파형(D-wave) 감시에서는 50% 이상 진폭 감소를 유의미한 IONM 감시 징후 변화로 설정해, 해당 변화가 있을 경우 수술을 중단하거나, 수술 진행 계획을 다소 변경하게 하였다. 그렇게 하여 수술전후의 McCormick grade 변화를 비교했고, IOM 적용 그룹이 대조군에 비해 유의미하게 McCormick grade가 호전됨을 보여줬다(mean; +0.28 vs –0.16; p = 0.0016). 이처럼 D-파형의 유용성은 여러 연구를 통해 입증되었으나, 아직 국내의 경우 비용 및 안전성 등과 관련해 정식 의료기기로 허가되지 않아, 실제 임상에 적용이 되지 못하고 있다. 본 증례도 척수수질내 병변으로 D-파형의 활용이 신경손상을 예방하는 데 도움이 되었을 것을 기대해볼 수 있지 않았을까 한다.
또한 수질내 종양이라는 해부학적 특성을 고려했을 때, 최근 점차 적용이 확대되고 있는 ‘척수 지도화(spinal cord mapping)’의 활용도 고려해야 하겠다. 실제 척수 종양 제거 시, 척수지도화를 활용해, 수술 중 병변 제거의 범위를 결정하고, 수술 후 환자의 근력 악화를 최소화하는 여러 사례들이 보고된 바 있다[3]. 본 증례의 경우도, 척수 MRI에서 볼 수 있듯이(Fig. 1-D and 1-E) 특히 좌측의 경우는 피질척수로를 포함하는 병변일 가능성이 높아, 척수 지도화 기법을 적용할 수 있는 사례로 생각되나, 아직 본 기관에서는 해당 술기를 활용하지 않고 있어, 효용성을 확인하지 못했다는 아쉬움이 있다.
IONM상의 변화와 수술 후 환자 예후와의 연관성을 분석함에 있어, IONM 감시 종류별로 ‘유의미한 경고 징후’의 기준을 어떻게 설정하는지와 수술 이후 어느 시기의 환자 상태를 ‘결과지표(outcome)’로 할 것이냐가 중요한 변수로 작용하게 된다. 실제로 많은 선행 연구들을 통해 SSEP의 경우는 거의 모든 종류의 수술에서 기준파형 대비 50% 이상의 진폭 감소 혹은 10% 이상의 잠복기 연장을 ‘alarm criteria’로 활용하는 것으로 정립된 상태이다. MEP의 경우는 척수 수질내 종양 제거수술에서는 수술 후 지속되는(permanent) 신경학적 결손에 대해서는 MEP 파형의 완전 소실을 기준으로 하는 게 표준적으로 여겨지나[8], 가역적인 수술 후 위약에 대해서는 MEP 진폭 감소의 ‘cut-off’ 값을 88%로 설정할 경우, 86%의 민감도와 74%의 특이도를 가질 수 있다는 연구 결과도 발표되었다[9]. 수술 후 신경학적 상태를 평가하는 ‘시기’의 영향에 대해서는 최근 kimchi 그룹이 28명의 척수 수질내 종양(해면상 혈관종 환자 3명 포함) 환자를 대상으로, MEP(기준파형 진폭 대비 80% 이상 감소) 감시를 시행한 결과와 수술 1일 후, 6주 후, 그리고 마지막 외래 진료 시(평균 19개월)의 기능상태(McCormick scale 활용)의 연관성을 분석한 결과를 발표하였다[10]. 평가시기가 뒤로 갈수록 MEP의 수술 후 기능상태에 대한 양성 예측율(positive predictive value)은 감소하고(57.9% → 50% → 33.3%), 음성 예측율(negative predictive value)은 증가하였다(66.7% → 87.5% → 88.9%). 이는 MEP 감시가 척수 수질내 종양 수술에서는 ‘장기’보다는 ‘단기’적인 신경학적 결손 발생을 예측하는 데 보다 유리하고, 단기적으로 위음성이 다소 있더라도 장기적으로 신경학적 기능이 유지될 수 있는 환자를 분류함에 강점을 가질 수 있다는 것을 의미하겠다.
척수 해면상 혈관종만을 대상으로 하는 IONM 연구는 현재까지 거의 없는 상태로, 최근 발표된 척수 해면상 혈관종 환자군 연구(case series)에서 수술 받는 모든 환자들에게 MEP/ SSEP를 적용했다는 언급은 있으나, 그 결과 및 해석에 대한 내용은 따로 없었고[11], 2022년 Niedermeyer 등이 17명의 척수 해면상 혈관종 환자군에서 수술적 절제를 시행하면서 MEP와 SSEP 감시를 적용하여, 그 결과와 수술 후의 신경학적 예후간 비교분석을 수행한 바 있다[5]. 해당 연구에서는 유의미한 MEP/SSEP의 변화를 각각 수술 시작시의 기준파형 진폭 대비 80%(MEP) 감소 및 50%(SSEP) 감소로 정의했는데, 2명의 환자가 일시적으로 MEP가 감소했다가 회복되었고, 이 중 한 명은 수술 후 신경학적 상태의 변화는 없었고, 한 명은 수술 직후에는 좌측 상지의 위약이 생겼으나(좌측 상지의 MEP 소실이 일시적으로 있던 환자), 3개월 이내 모두 회복되었다. 이와 달리, MEP의 진폭이 80% 이상 감소한 후 회복되지 않은 채로 종료된 환자가 3명이 있었는데, 이 중 2명은 수술 후 신경학적 변화는 없었으나, 한 명은 수술 후 1년 뒤에까지 지속되는 좌측 하지의 위약이 새롭게 발생하였다. SSEP는 3명의 환자가 비가역적인 50% 이상의 진폭 감소를 보였는데, 이들 모두에서 수술 후 1년 이상 지속되는 감각 저하가 새롭게 발생했다. 이를 바탕으로 수술 후 신경학적 예후를 예측하는 부분에서의 IONM의 정확도(accuracy)를 산출했을 때, ‘비가역적인 MEP 진폭의 80% 이상 감소’의 경우, 단기 예후(퇴원 시 측정)에 있어서는 다소 낮은 정확도(민감도 25%, 특이도 50%)를 보였으나, 장기 예후(수술 후 1년)는 비교적 높은 정확도(민감도 100%, 특이도 73%)를 보였다. ‘비가역적인 SSEP 진폭의 50% 이상 감소’의 경우는 단기 예후(민감도 75%, 특이도 100%) 및 장기 예후(민감도 67%, 특이도 93%) 모두 높은 정확도를 보여줬다. 동일한 기준치의 경고 기준을 적용하되, ‘가역적’인 MEP/SSEP의 변화를 ‘비가역적’인 MEP/SSEP 변화에 비교했을 때는 상대적으로 장기적 신경학적 결손 발생의 위험도는 떨어져(MEP, 0.56; SSEP, 0.4), 저자들은 상기 결과를 바탕으로 척수내 해면상 혈관종의 수술에서는 가역적인 MEP/ SSEP의 변화는 크게 위험하지 않고, 비가역적인 MEP/SSP 진폭 감소를 유의미한 경고 기준으로 삼을 수 있을 것으로 제시하였다.
본 증례의 환자는 좌/우측 하지에서 서로 다른 IONM 감시 패턴을 보여줬다. 양측에서 모두 혈관종 제거 도중, 시간의 차이는 있었지만, SSEP와 MEP 모두 유의미하게 감소하였다가, 우측의 경우는 다시 회복되어 수술 종료시까지 잘 유지되었지만, 좌측은 회복되지 못하였다. 선행 연구[5]의 결과에 적용시켜보면, 가역적 변화를 보인 좌측은 수술 후 신경학적 악화가 없을 가능성이 높고, 비가역적 변화를 보인 우측은 신경학적 결손이 나타날 가능성이 있다고 예측할 수 있는데, 실제 수술 후 신경학적 상태와 일치함을 알 수 있다. 수술 1년 후의 평가에서도 신경학적 결손은 유지된 상태로, 본 증례 환자의 IONM 결과는 ‘양성(true positive)’이라고 판단할 수 있겠다.







